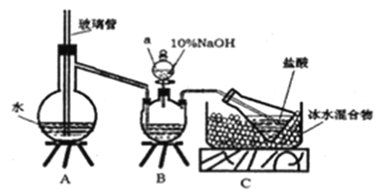
题目内容
【题目】目前,人们对环境保护、新能源开发很重视。
(1)汽车尾气中含有CO、NO2等有毒气体,对汽车加装尾气净化装置,可使有毒气体转化为无毒气体:4CO(g)+2NO2(g)![]() 4CO2(g)+N2(g),恒温恒容条件下,能够说明该反应已达到平衡状态的是________(填序号);
4CO2(g)+N2(g),恒温恒容条件下,能够说明该反应已达到平衡状态的是________(填序号);
A.容器内混合气体颜色不再变化 B.容器内的压强保持不变
C.2v逆(NO2)=v正(N2) D.容器内混合气体密度保持不变
(2)用活性炭还原法也可以处理氮氧化物。某研究小组向某密闭容器中加入一定量的活性炭和NO,发生反应C(s)+2NO(g)![]() N2(g)+CO2(g) ΔH。在T1℃时,反应进行到不同时间测得各物质的量浓度如下:
N2(g)+CO2(g) ΔH。在T1℃时,反应进行到不同时间测得各物质的量浓度如下:
时间/min 浓度/( mol·L-1) | 0 | 10 | 20 | 30 | 40 | 50 |
NO | 1.0 | 0.58 | 0.40 | 0.40 | 0.48 | 0.48 |
N2 | 0 | 0.21 | 0.30 | 0.30 | 0.36 | 0.36 |
CO2 | 0 | 0.21 | 0.30 | 0.30 | 0.36 | 0.36 |
①根据图表数据分析T1℃时,该反应在0~20 min的平均反应速率v(CO2)=________;计算该反应的平衡常数K=______。
②根据上表数据判断,由30 min到40 min时改变的条件可能是(任写一种)__________________。
③30 min后升高温度至T2℃,达到新平衡时,容器中NO、N2、CO2浓度之比为5∶3∶3,此时NO的转化率_______(填“升高”或“降低”),ΔH_____0(填“>”或“<”)。
(3)以CO2与NH3为原料可合成化肥尿素[化学式为CO(NH2)2]。已知:
①2NH3(g)+CO2(g)=NH2CO2NH4(s) ΔH=-l59.5 kJ· mol-1
②NH2CO2NH4(s)=CO(NH2)2(s)+H2O(g) ΔH= +116.5 kJ· mol-1
③H2O(l)=H2O(g) ΔH=+44.0 kJ· mol-1
写出CO2与NH3合成尿素和液态水的热化学反应方程式_____________________。
(4)科学家利用原电池原理,在酸性介质中将NO2转化为HNO3,则该转化的负极反应式为:_________________________________。
【答案】 A、B 0.015 mol·L-1·min-1 0.56(或9/16) 通入一定量NO或适当缩小容器体积或者充入一定量1∶1的氮气和二氧化碳 降低 < 2NH3(g)+CO2(g)=CO(NH2)2(s)+H2O(l)ΔH=–87.0 kJ·mol-1 NO2-e-+H2O=NO3-+2H+
【解析】(1). A. 容器内混合气体颜色不再变化,说明各物质的浓度不再变化,反应达到平衡状态,故A正确;B. 因该反应为反应前后气体体积不相等的可逆反应,则容器内的压强保持不变,说明反应达到平衡状态,故B正确;C. 当2v逆(NO2)=v正(N2)时,该反应的正逆反应速率不相等,反应没有达到平衡状态,故C错误;D. 在恒温恒容条件下,容器内混合气体密度始终不变,则容器内混合气体密度保持不变,不能说明反应达到平衡状态,故D错误;答案为:A、B;
(2). ①. T1℃时,该反应在0~20 min的平均反应速率v(CO2)=0.3mol/L÷20min=0.015 mol·L-1·min-1,该反应的平衡常数K=![]() =
=![]() = 0.56(或9/16),故答案为:0.015 mol·L-1·min-1;0.56(或9/16);
= 0.56(或9/16),故答案为:0.015 mol·L-1·min-1;0.56(或9/16);
②. 30min到40min改变某个反应条件后再次达到平衡时K=![]() =
=![]() = 0.56,平衡常数K没有改变,说明反应温度不变,由图表数据分析,30 min到40 min时改变某个反应条件,再次达到平衡时,各气体的浓度都增大相同的倍数,又因C(s)+2NO(g)
= 0.56,平衡常数K没有改变,说明反应温度不变,由图表数据分析,30 min到40 min时改变某个反应条件,再次达到平衡时,各气体的浓度都增大相同的倍数,又因C(s)+2NO(g)![]() N2(g)+CO2(g)为反应前后气体体积不变的可逆反应,则改变的条件可能是通入一定量NO或适当缩小容器体积或者充入一定量1∶1的氮气和二氧化碳,故答案为:通入一定量NO或适当缩小容器体积或者充入一定量1∶1的氮气和二氧化碳;
N2(g)+CO2(g)为反应前后气体体积不变的可逆反应,则改变的条件可能是通入一定量NO或适当缩小容器体积或者充入一定量1∶1的氮气和二氧化碳,故答案为:通入一定量NO或适当缩小容器体积或者充入一定量1∶1的氮气和二氧化碳;
③. 30 min后升高温度至T2℃,达到新平衡时,容器中NO、N2、CO2的浓度之比为5∶3∶3,由反应方程式可知,N2、CO2的浓度之比始终为1∶1,原平衡时NO和N2的浓度之比为4∶3<5∶3,说明升高温度平衡逆向移动,NO的转化率降低,该反应为放热反应,ΔH<0,故答案为:降低;<;
(3). 已知①2NH3(g)+CO2(g)=NH2CO2NH4(s)ΔH=-l59.5 kJ· mol-1、②NH2CO2NH4(s)=CO(NH2)2(s)+H2O(g)ΔH= +116.5 kJ· mol-1、③H2O(l)=H2O(g)ΔH=+44.0 kJ· mol-1,根据盖斯定律可知,①+②-③得:2NH3(g)+CO2(g)=CO(NH2)2(s)+H2O(l)ΔH=–87.0 kJ·mol-1,故答案为:2NH3(g)+CO2(g)=CO(NH2)2(s)+H2O(l)ΔH=–87.0 kJ·mol-1;
(4). 科学家利用原电池原理,在酸性介质中将NO2转化为HNO3,氮元素的化合价从+4价升高到+5价,说明在负极上二氧化氮失电子发生氧化反应,负极的反应式为:NO2-e-+H2O=NO3-+2H+,故答案为:NO2-e-+H2O=NO3-+2H+。

【题目】用下列装置制备二氧化氮气体,并探究相关产物性质。
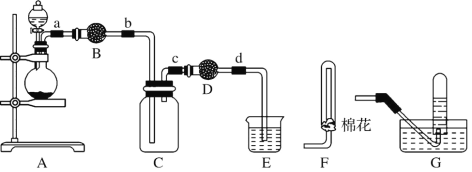
(1) 装置A中的分液漏斗盛装的液体是____,烧瓶中预先加入的是铜屑,铁的价格比铜的价格低,此处用铜不用铁的原因是______________。
(2) 干燥管B、D中盛装的干燥剂可以是____(填“浓硫酸”、“无水氯化钙”、“五氧化二磷”或“碱石灰”),干燥管D中干燥剂的作用是______________。
(3) 装置E的作用是吸收尾气,吸收过程中发生反应的化学方程式如下,请将其补充完整。
NaOH+ NO2![]() + NaNO2+ H2O ______
+ NaNO2+ H2O ______
(4) 某化学兴趣小组认为铜和适量浓硝酸反应产生的气体中含NO,选用下列必要的装置(N2和O2的用量可自由控制)完成验证实验。
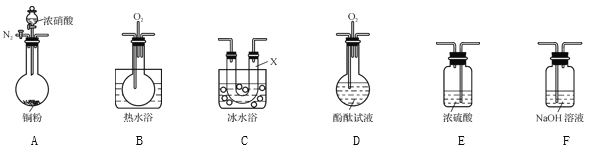
已知:
i. NO+NO2+2OH-![]() 2NO2-+H2O
2NO2-+H2O
ii气体液化温度如下:
气体 | NO2 | NO |
液化温度 | 21 ℃ | -152 ℃ |
①仪器的连接顺序(按从左→右连接,填各仪器字母)为________。
②实验时先检查装置气密性后,再加入试剂,在反应前的操作是_______。
③确认气体中含NO的现象是__________;装置C的作用是____。
④NH3催化还原氮氧化物(SCR)技术是目前应用最广泛的气体中氮氧化物脱除技术。现在有NO、NO2的混合气6 L,可用同温同压下7 L NH3恰好使其完全转化为N2,则原混合气体中NO和NO2的物质的量之比为____。