题目内容
【题目】维尔纳配合物M是一种橙黄色单斜晶体。该晶体以浓氨水、双氧水、CoCl26H2O、NH4Cl 为原料在加热条件下通过活性炭的催化来合成。为探究该晶体的组成,设计了如下实验:
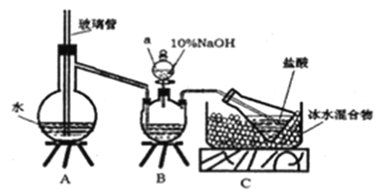
步骤一,氮的测定:准确称取一定量橙黄色晶体,加入适量水溶解,注入下图所示的三预瓶中,然后逐滴加入足量10%NaOH溶液,通入 水蒸气,将样品中的氨全部蒸出,用500.00mL7.0mol /L的盐酸溶液吸收,吸收结束后量取吸收液25.00mL,用2.00mol/L的NaOH溶液滴定过量的盐酸,终点消耗NaOH溶液12.50mL。
步骤二,氯的测定: 准确称取橙黄色晶体wg,配成溶液后用AgNO3标准溶液滴定,以K2CrO4溶液为指示剂,至出现淡红色沉淀不再消失为终点(Ag2CrO4为砖红色沉淀)。
(1)装置B中仪器a的名称为_______。
(2)裝置A、B 三脚架处应放置一个酒精灯作为热源,酒精灯应放置在___(填“A”或“B”) 处。
(3) 步骤一所称取的样品中含氮的质量为_______g。
(4)有同学提出装置C中所用盐酸的浓度过大易挥发,会造成测得氮的含量结果将____ (填“偏高”、“偏低”或“无影响”); 冰水混合物的作用是________。
(5) 测定氯的过程中,使用棕色滴定管的原因是_______; 出现浅红色沉淀时,若溶液中c(CrO42-)=0.0025mol/L,通过计算说明该实验可以使用K2CrO4溶液为指示剂的原因______ (呈现计算过程)。已知: Ksp(Ag2CrO4)=1.0×10-12 Kp(AgCl)=1.8×10-10
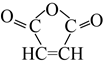
(6)经上述实验测定,配合物M中钻、氮、氯的物质的量之比为1: 6: 3,其中氮元素以氨的形式存在。制备M的化学方程式为__________________。
【答案】 分液漏斗 A 42.00 偏高 减少盐酸的挥发,有利于氨气的吸收 AgNO3见光易分解 当溶液中出现Ag2CrO4沉定时,c2(Ag+)×c(CrO42-)=1.0×10-12,代入求得c(Ag+)=2.0×10-5mol/L.此时c(Ag+)Xc(C1-)=1.8×10-10,代入求得c(Cl-)=9.0×10-6mol/L<1.0×10-5mol/L,所以当出现浅红色沉淀时Cl-已完全沉淀 2CoCl2+2NH4Cl+10NH3+H2O2![]() 2[Co(NH3)6]Cl3+2H2O
2[Co(NH3)6]Cl3+2H2O
【解析】考查实验方案设计与评价,(1)仪器a的特点,仪器a为分液漏斗;(2)依据题意,在晶体中加入NaOH溶液充分反应后,通入水蒸气将氨全部蒸出,因此酒精灯应放置在A处,产生水蒸气;NaOH滴定的是过量的盐酸,过量的盐酸物质的量为12.50×10-3×2mol=0.025mol,则500mL吸收液中与NH3反应的盐酸的量为(500×10-3×7-0.025×500/25)mol=3mol,根据NH3+HCl=NH4Cl,即n(NH3)=n(HCl)=3mol,根据N元素守恒,样品种m(N)=3×14g=42.00g;(4)NH3全部被吸收,由于盐酸的挥发,造成过量的盐酸的量减少,即吸收NH3的HCl量偏大,会造成测的N的含量结果将偏高;冰水混合物的作用是减少盐酸的挥发,有利于氨气的吸收;(5)AgNO3见光分解,因此滴定过程用棕色滴定管;当溶液中出现Ag2CrO4沉定时,c2(Ag+)×c(CrO42-)=1.0×10-12,代入求得c(Ag+)=2.0×10-5mol/L,此时c(Ag+)×c(C1-)=1.8×10-10,代入求得c(Cl-)=9.0×10-6mol/L<1.0×10-5mol/L,所以当出现浅红色沉淀时Cl-已完全沉淀;(6)配合物M中钴、氮、氯的物质的量之比为1:6:3,其中氮元素以氨的形式存在,M的化学式为[Co(NH3)6]Cl3,配合物以浓氨水、双氧水、CoCl2·6H2O、NH4Cl为原料,制备配合物M,因此化学反应方程式为2CoCl2+2NH4Cl+10NH3+H2O2![]() 2[Co(NH3)6]Cl3+2H2O。
2[Co(NH3)6]Cl3+2H2O。

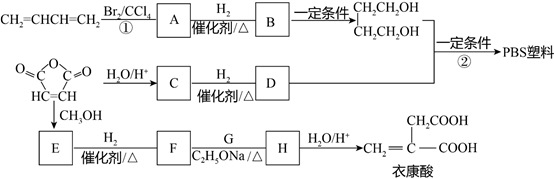
【题目】实验室制备1,2﹣二溴乙烷的反应原理如下:
CH3CH2OH  CH2=CH2
CH2=CH2
CH2=CH2+Br2→BrCH2CH2Br
可能存在的主要副反应有:乙醇在浓硫酸的存在下在140℃脱水生成乙醚.
用少量的溴和足量的乙醇制备1,2﹣二溴乙烷的装置如图所示:
有关数据列表如下:
乙醇 | 1,2﹣二溴乙烷 | 乙醚 | |
状态 | 无色液体 | 无色液体 | 无色液体 |
密度/gcm﹣3 | 0.79 | 2.2 | 0.71 |
沸点/℃ | 78.5 | 132 | 34.6 |
熔点/℃ | -130 | 9 | ﹣116 |
回答下列问题:
(1)在此制各实验中,要尽可能迅速地把反应温度提高到170℃左右,其最主要目的是;(填正确选项前的字母)
a.引发反应 b.加快反应速度 c.防止乙醇挥发 d.减少副产物乙醚生成
(2)在装置C中应加入 , 其目的是吸收反应中可能生成的酸性气体:(填正确选项前的字母)
a.水 b.浓硫酸 c.氢氧化钠溶液 d.饱和碳酸氢钠溶液
(3)若产物中有少量副产物乙醚.可用的方法除去;
(4)反应过程中应用冷水冷却装置D,其主要目的是避免溴大量挥发,但又不能过度冷却(如用冰水),其原因是 .
【题目】目前,人们对环境保护、新能源开发很重视。
(1)汽车尾气中含有CO、NO2等有毒气体,对汽车加装尾气净化装置,可使有毒气体转化为无毒气体:4CO(g)+2NO2(g)![]() 4CO2(g)+N2(g),恒温恒容条件下,能够说明该反应已达到平衡状态的是________(填序号);
4CO2(g)+N2(g),恒温恒容条件下,能够说明该反应已达到平衡状态的是________(填序号);
A.容器内混合气体颜色不再变化 B.容器内的压强保持不变
C.2v逆(NO2)=v正(N2) D.容器内混合气体密度保持不变
(2)用活性炭还原法也可以处理氮氧化物。某研究小组向某密闭容器中加入一定量的活性炭和NO,发生反应C(s)+2NO(g)![]() N2(g)+CO2(g) ΔH。在T1℃时,反应进行到不同时间测得各物质的量浓度如下:
N2(g)+CO2(g) ΔH。在T1℃时,反应进行到不同时间测得各物质的量浓度如下:
时间/min 浓度/( mol·L-1) | 0 | 10 | 20 | 30 | 40 | 50 |
NO | 1.0 | 0.58 | 0.40 | 0.40 | 0.48 | 0.48 |
N2 | 0 | 0.21 | 0.30 | 0.30 | 0.36 | 0.36 |
CO2 | 0 | 0.21 | 0.30 | 0.30 | 0.36 | 0.36 |
①根据图表数据分析T1℃时,该反应在0~20 min的平均反应速率v(CO2)=________;计算该反应的平衡常数K=______。
②根据上表数据判断,由30 min到40 min时改变的条件可能是(任写一种)__________________。
③30 min后升高温度至T2℃,达到新平衡时,容器中NO、N2、CO2浓度之比为5∶3∶3,此时NO的转化率_______(填“升高”或“降低”),ΔH_____0(填“>”或“<”)。
(3)以CO2与NH3为原料可合成化肥尿素[化学式为CO(NH2)2]。已知:
①2NH3(g)+CO2(g)=NH2CO2NH4(s) ΔH=-l59.5 kJ· mol-1
②NH2CO2NH4(s)=CO(NH2)2(s)+H2O(g) ΔH= +116.5 kJ· mol-1
③H2O(l)=H2O(g) ΔH=+44.0 kJ· mol-1
写出CO2与NH3合成尿素和液态水的热化学反应方程式_____________________。
(4)科学家利用原电池原理,在酸性介质中将NO2转化为HNO3,则该转化的负极反应式为:_________________________________。