题目内容
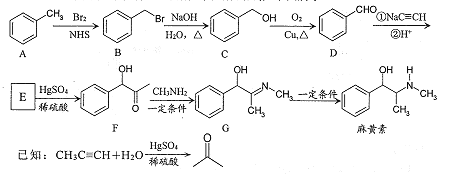
【题目】工业上常以铬铁矿(主要成分为亚铬酸亚铁FeCr2O4,还有Al2O3、SiO2等杂质)为主要原料生产红矾钠(Na2Cr2O7),某实验小组模拟其流程如下图所示:
(1)步骤①中,焙烧时所用的仪器材质应选用_______(填“瓷质”、“铁质”或“石英质”),二氧化硅与纯碱反应的化学方程式为___________。
(2)配平步骤①中主要反应:_________
____FeCr2O4+___O2+___Na2CO3![]() ___Fe2O3+___Na2CrO4+___CO2
___Fe2O3+___Na2CrO4+___CO2
(3)操作④中,酸化时,CrO42-转化为Cr2O72-,写出平衡转化的离子方程式:______________。
(4)步骤③用硫酸将溶液的pH调至中性,所得滤渣的主要成分是___________、____________;
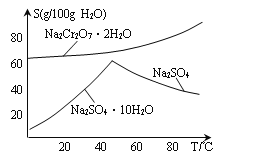
(5)下图是Na2Cr2O7·2H2O和Na2SO4的溶解度曲线,步骤④中获得固态副产品Na2SO4的实验操作方法为____________、___________。
(6)工业上常用电解法处理含Cr2O72-的酸性废水,用金属铁作阳极、石墨作阴极,一段时间后产生Fe(OH)3和Cr(OH)3沉淀。若电解后溶液中c(Cr3+)=3.0×10-5mol·L-1,则c(Fe3+)=_____。(已知Ksp[Fe(OH)3]=4.0×10-38mol·L-1,Ksp[Cr(OH)3]=6.0×10-31mol·L-1)
(7)CrO5的结构式为 ,该氧化物中Cr为_______价。
,该氧化物中Cr为_______价。
【答案】 铁质 Na2CO3+SiO2![]() Na2SiO3+CO2↑ 4 7 8 2 8 8 2CrO42-+2H+Cr2O72-+H2O H2SiO3(H4SiO4或SiO2·H2O) Al(OH)3 加热浓缩 趁热过滤 2.0×10-12mol·L-1 +6
Na2SiO3+CO2↑ 4 7 8 2 8 8 2CrO42-+2H+Cr2O72-+H2O H2SiO3(H4SiO4或SiO2·H2O) Al(OH)3 加热浓缩 趁热过滤 2.0×10-12mol·L-1 +6
【解析】(1). 步骤①中,在铬铁矿中加入纯碱焙烧,使用的仪器是坩埚,瓷质和石英质坩埚中均含有二氧化硅,在高温下二氧化硅和纯碱反应生成硅酸钠和二氧化碳,化学方程式为:Na2CO3+SiO2![]() Na2SiO3+CO2↑,因此应选用铁质坩埚,故答案为:铁质;Na2CO3+SiO2
Na2SiO3+CO2↑,因此应选用铁质坩埚,故答案为:铁质;Na2CO3+SiO2![]() Na2SiO3+CO2↑;
Na2SiO3+CO2↑;
(2). FeCr2O4中铁元素的化合价是+2价,氧元素的化合价是2价,则铬元素的化合价为+3价,O2中氧元素的化合价是0价,反应后铁元素的化合价是+3价,铬元素的化合价是+6价,氧元素的化合价是2价,根据得失电子守恒和原子守恒,该反应的化学方程式为:4FeCr2O4+7O2+8Na2CO3![]() 2Fe2O3+8Na2CrO4+8CO2,故答案为:4 7 8 2 8 8;
2Fe2O3+8Na2CrO4+8CO2,故答案为:4 7 8 2 8 8;
(3). 在操作④中,酸化的目的是使CrO42-转化为Cr2O72-,该反应为可逆反应且铬元素的化合价没有变化,根据原子守恒和电荷守恒,该平衡转化的离子方程式为:2CrO42-+2H+![]() Cr2O72-+H2O,故答案为:2CrO42-+2H+
Cr2O72-+H2O,故答案为:2CrO42-+2H+![]() Cr2O72-+H2O;
Cr2O72-+H2O;
(4). 步骤③用硫酸调节溶液的pH至中性,Na2SiO3、NaAlO2生成不溶的H2SiO3和Al(OH)3,过滤,所得滤渣为H2SiO3和Al(OH)3;故答案为:H2SiO3(H4SiO4或SiO2·H2O);Al(OH)3;
(5). 据图可知,温度升高有利于硫酸钠结晶析出,同时可以防止Na2Cr2O72H2O结晶析出,所以获得副产品Na2SO4的实验操作方法为:将滤液2加热浓缩后趁热过滤,得副产品Na2SO4,故答案为:加热浓缩;趁热过滤;
(6). Ksp[Fe(OH)3]= c(Fe3+)×c3(OH-)=4.0×10-38mol·L-1,Ksp[Cr(OH)3]= c(Cr3+)×c3(OH-)= 3.0×10-5mol·L-1×c3(OH-)=6.0×10-31mol·L-1,联立得:c(Fe3+)=2.0×10-12mol·L-1,故答案为:2.0×10-12mol·L-1;
(7). 由CrO5的结构式可知,一个Cr原子与5个O原子形成6个Cr-O极性共价键,共用电子对都偏向于O原子,所以该氧化物中Cr为+6价,故答案为:+6。

【题目】实验室制备1,2﹣二溴乙烷的反应原理如下:
CH3CH2OH  CH2=CH2
CH2=CH2
CH2=CH2+Br2→BrCH2CH2Br
可能存在的主要副反应有:乙醇在浓硫酸的存在下在140℃脱水生成乙醚.
用少量的溴和足量的乙醇制备1,2﹣二溴乙烷的装置如图所示:
有关数据列表如下:
乙醇 | 1,2﹣二溴乙烷 | 乙醚 | |
状态 | 无色液体 | 无色液体 | 无色液体 |
密度/gcm﹣3 | 0.79 | 2.2 | 0.71 |
沸点/℃ | 78.5 | 132 | 34.6 |
熔点/℃ | -130 | 9 | ﹣116 |
回答下列问题:
(1)在此制各实验中,要尽可能迅速地把反应温度提高到170℃左右,其最主要目的是;(填正确选项前的字母)
a.引发反应 b.加快反应速度 c.防止乙醇挥发 d.减少副产物乙醚生成
(2)在装置C中应加入 , 其目的是吸收反应中可能生成的酸性气体:(填正确选项前的字母)
a.水 b.浓硫酸 c.氢氧化钠溶液 d.饱和碳酸氢钠溶液
(3)若产物中有少量副产物乙醚.可用的方法除去;
(4)反应过程中应用冷水冷却装置D,其主要目的是避免溴大量挥发,但又不能过度冷却(如用冰水),其原因是 .
【题目】目前,人们对环境保护、新能源开发很重视。
(1)汽车尾气中含有CO、NO2等有毒气体,对汽车加装尾气净化装置,可使有毒气体转化为无毒气体:4CO(g)+2NO2(g)![]() 4CO2(g)+N2(g),恒温恒容条件下,能够说明该反应已达到平衡状态的是________(填序号);
4CO2(g)+N2(g),恒温恒容条件下,能够说明该反应已达到平衡状态的是________(填序号);
A.容器内混合气体颜色不再变化 B.容器内的压强保持不变
C.2v逆(NO2)=v正(N2) D.容器内混合气体密度保持不变
(2)用活性炭还原法也可以处理氮氧化物。某研究小组向某密闭容器中加入一定量的活性炭和NO,发生反应C(s)+2NO(g)![]() N2(g)+CO2(g) ΔH。在T1℃时,反应进行到不同时间测得各物质的量浓度如下:
N2(g)+CO2(g) ΔH。在T1℃时,反应进行到不同时间测得各物质的量浓度如下:
时间/min 浓度/( mol·L-1) | 0 | 10 | 20 | 30 | 40 | 50 |
NO | 1.0 | 0.58 | 0.40 | 0.40 | 0.48 | 0.48 |
N2 | 0 | 0.21 | 0.30 | 0.30 | 0.36 | 0.36 |
CO2 | 0 | 0.21 | 0.30 | 0.30 | 0.36 | 0.36 |
①根据图表数据分析T1℃时,该反应在0~20 min的平均反应速率v(CO2)=________;计算该反应的平衡常数K=______。
②根据上表数据判断,由30 min到40 min时改变的条件可能是(任写一种)__________________。
③30 min后升高温度至T2℃,达到新平衡时,容器中NO、N2、CO2浓度之比为5∶3∶3,此时NO的转化率_______(填“升高”或“降低”),ΔH_____0(填“>”或“<”)。
(3)以CO2与NH3为原料可合成化肥尿素[化学式为CO(NH2)2]。已知:
①2NH3(g)+CO2(g)=NH2CO2NH4(s) ΔH=-l59.5 kJ· mol-1
②NH2CO2NH4(s)=CO(NH2)2(s)+H2O(g) ΔH= +116.5 kJ· mol-1
③H2O(l)=H2O(g) ΔH=+44.0 kJ· mol-1
写出CO2与NH3合成尿素和液态水的热化学反应方程式_____________________。
(4)科学家利用原电池原理,在酸性介质中将NO2转化为HNO3,则该转化的负极反应式为:_________________________________。