题目内容
【题目】Ⅰ.可逆反应3A(g)![]() 3B(?)+C(?) ΔH>0达到化学平衡后,
3B(?)+C(?) ΔH>0达到化学平衡后,
(1)升高温度,用“变大” “变小” “不变”或“无法确定”填空。
①若B、C都是气体,气体的平均相对分子质量________;
②若B、C都不是气体,气体的平均相对分子质量________;
③若B是气体,C不是气体,气体的平均相对分子质量________;
(2)如果平衡后保持温度不变,将容器体积增加一倍,新平衡时A的浓度是原来的50%,则B是________态,C是________态。
Ⅱ.某实验人员在一定温度下的密闭容器中,充入一定量的H2和CO,发生反应:2H2(g)+CO(g)![]() CH3OH(g),测定的部分实验数据如表所示:
CH3OH(g),测定的部分实验数据如表所示:
t(s) | 0 | 500 | 1 000 |
c(H2)( mol·L-1) | 5.00 | 3.52 | 2.48 |
c(CO)( mol·L-1) | 2.50 |
(1)在500 s内用H2表示的化学反应速率是__________________。
(2)在1 000 s内用CO表示的化学反应速率是___________________,1000 s时CO的转化率是________。
(3)在500 s时生成的甲醇(CH3OH)的浓度是_______________________。
【答案】变小不变变小气液或固2.96×10-3mol·(L·s) -11.26×10-3mol·(L·s) -150.4%0.74 mol·L-1
【解析】
Ⅰ.(1)反应为吸热反应,升高温度平衡向正反应方向移动,结合物质的状态判断相对分子质量的变化;
①若B、C都是气体,气体的总质量不变,但物质的量增大,则气体的平均相对分子质量变小,故答案为:变小;
②若B、C都不是气体,气体只有A,则气体的平均相对分子质量不变,故答案为:不变;
③若B是气体,C不是气体,气体的物质的量不变,但气体的质量减小,则相对分子质量减小,故答案为:变小;
(2)如果平衡后保持温度不变,将容器体积增加一倍,新平衡时A的浓度是原来的50%,说明平衡不移动,反应物气体的计量数等于生成物气体的计量数,所以B为气体,C为固体或液体,故答案为:气;液或固;
Ⅱ.(1)在500s内用H2表示的化学反应速率为:v(H2)=![]() =2.96×10-3mol/(Ls),故答案为:2.96×10-3mol/(Ls);
=2.96×10-3mol/(Ls),故答案为:2.96×10-3mol/(Ls);
(2)在1000s内用氢气表示的化学反应速率是:v(H2)=![]() =2.52×10-3mol/(Ls),则1000s内用CO表示的化学反应速率为:v(CO)=
=2.52×10-3mol/(Ls),则1000s内用CO表示的化学反应速率为:v(CO)=![]() v(H2)=1.26×10-3mol/(Ls);1000s时H2的消耗浓度为:△c(H2)=(5.00-2.48)mol/L=2.52mol/L,氢气的转化率为
v(H2)=1.26×10-3mol/(Ls);1000s时H2的消耗浓度为:△c(H2)=(5.00-2.48)mol/L=2.52mol/L,氢气的转化率为![]() ×100%=50.4%,故答案为:1.26×10-3mol/(Ls);50.4%;
×100%=50.4%,故答案为:1.26×10-3mol/(Ls);50.4%;
(3)在500s时氢气的浓度变化为:△c(H2)=(5.00-3.52)mol/L=1.48mol/L,由反应2H2(g)+CO(g)CH3OH(g)可知,生成甲醇的物质的量浓度为:c(CH3OH)=![]() △c(H2)=0.74mol/L,故答案为:0.74mol/L。
△c(H2)=0.74mol/L,故答案为:0.74mol/L。

【题目】Ⅰ.控制变量法是化学实验的一种常用方法。下表是某学习小组研究等物质的量浓度的稀硫酸和锌反应的实验数据,分析以下数据,回答下列问题:
序号 | 硫酸的体积/mL | 锌的质量/g | 锌的形状 | 温度/℃ | 完全溶于酸的时间/s | 生成硫酸锌的质量/g |
1 | 50.0 | 2.0 | 薄片 | 25 | 100 | m1 |
2 | 50.0 | 2.0 | 颗粒 | 25 | 70 | m2 |
3 | 50.0 | 2.0 | 颗粒 | 35 | 35 | m3 |
4 | 50.0 | 2.0 | 粉末 | 25 | 45 | 5.0 |
5 | 50.0 | 6.0 | 粉末 | 35 | 30 | m5 |
6 | 50.0 | 8.0 | 粉末 | 25 | t6 | 16.1 |
7 | 50.0 | 10.0 | 粉末 | 25 | t7 | 16.1 |
(1)化学反应速率本质上是由物质的性质决定的,但外界条件也会影响反应速率的大小。本实验中实验2和实验3对比得出的结论是______________________________。
(2)我们最好选取实验________(填3个实验序号)研究锌的形状对反应速率的影响。
(3)若采用与实验1完全相同的条件,但向反应容器中滴加少量硫酸铜溶液,发现反应速率明显加快。原因是______________________________。
(4)利用表中数据,可以求得:硫酸的物质的量浓度是________mol/L。
Ⅱ.某温度时,在5 L的容器中,X、Y、Z三种气体的物质的量随时间的变化曲线如图所示。请通过计算回答下列问题:
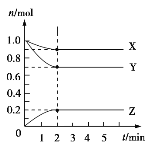
(5)反应开始至2 min,Y的平均反应速率______________________。
(6)分析有关数据,写出X、Y、Z的反应方程式_________________。

