��Ŀ����
����Ŀ����������ۺ����ü������ڽ�Լ��Դ���������ڱ���������ʵ�������÷����ɵ�ص�ͭñ��Zn��Cu�ܺ���ԼΪ99%������ͭ���Ʊ�ZnO�IJ���ʵ�����������
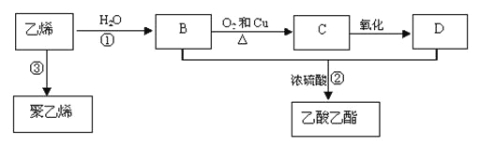
��1����д��ͭñ�ܽ������з�����Ӧ�Ļ�ѧ����ʽ ��
��ͭñ�ܽ���轫��Һ�й���H2O2��ȥ����ȥH2O2�ļ�㷽���� ��
��2��Ϊȷ������п������Ҫ�ɷ�ΪZn��ZnO������Ϊ��������������������ʵ������ⶨ��ȥH2O2����Һ��Cu2���ĺ�����ʵ�����Ϊ��ȷ��ȡһ������ĺ���Cu2������Һ�ڴ�����ƿ�У�������ˮϡ�ͣ�����pH=3��4���������KI����Na2S2O3����Һ�ζ����յ㡣���������е����ӷ���ʽ���£�
2Cu2����4I��=2CuI����ɫ������I2 I2��2![]() =2I����
=2I����![]()
���ζ�ѡ�õ�ָʾ��Ϊ ���ζ��յ�۲쵽������Ϊ ��
�����ζ�ǰ��Һ��H2O2û�г�������������Cu2���ĺ������� ���ƫ�ߡ�����ƫ�͡��������䡱����
��3����֪pH��11ʱZn��OH��2������NaOH��Һ����[Zn��OH��4]2�����±��г����������������������������pH����ʼ������pH����������Ũ��Ϊ1.0 mol��L��1������
Fe3�� | Fe2�� | Zn2�� | |
��ʼ������pH | 1.1 | 5.8 | 5.9 |
��ȫ������pH | 3.2 | 8.8 | 8.9 |
ʵ���п�ѡ�õ��Լ���30% H2O2��1.0 mol��L��1HNO3��1.0 mol��L��1 NaOH��
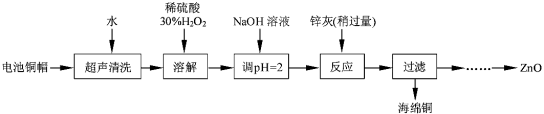
������ͭ������Һ�Ʊ�ZnO��ʵ�鲽������Ϊ��
�� ��
�� ��
�� ���ˣ�
�� ��
�� ���ˡ�ϴ�ӡ�����
�� 900�����ա�
���𰸡���1����Cu��H2O2��H2SO4=CuSO4��2H2O���ڼ�������������
��2���ٵ�����Һ����Һ��ɫ��ȥ���Ұ�����ڲ��ָ�����ƫ��
��3��������Һ�м����Թ���30%��H2O2��ʹ���ַ�Ӧ
����Ӧ�����Һ�еμ�1.0 moL�� L��1��NaOH��Һ��������Һ��pHԼΪ5����3.2��pH��5.9��
������Һ�еμ�1.0 moL�� L��1���������ƣ�����pHԼΪ10����8.9��pH��11��
��������
��������������ɵ�ص�ͭñ��ˮ����ϴ��ȥ������Ŀ��������ʣ�Ȼ�����ϡ�����˫��ˮ��˫��ˮ����ǿ�����ԣ�������������������ͭ����ͭ�Σ������������ƽ������ԣ�Ȼ�����������п�ң�����п�Ļ�����ǿ��ͭ�����ܰ�ͭ��������Һ���û�������ʣ��п�Ļ������Ʊ�ZnO��
��1������Ϊ˫��ˮ��������Һ���Ȱ�ͭ����������ͭ����Ȼ����һ�����ķ�Ӧ���γ�һ��ƽ�⣬�����γɵ�����ͭ���Ͼͻᱻϡ�����ܽ⣬ƽ�ⱻ���ƣ���Ӧ����������У��ʶ����ܽ⣬��Ӧ�Ļ�ѧ����ʽΪ��Cu+H2O2+H2SO4=CuSO4+2H2O��
�ʴ�Ϊ��Cu+H2O2+H2SO4=CuSO4+2H2O��
�ڹ����������ʱȽ��ȶ��������ȵ�153������ҵķֽ�Ϊˮ������������Һ�й�����H2O2 ��ȥ�ɼ���������
�ʴ�Ϊ���������У�
��2���ٵ�����ҺΪָʾ���������һ��Na2S2O3��Һ����ʱ����Һ��ɫ��ȥ���������ɫ���䣬˵���ζ������յ���
�ʴ�Ϊ��������Һ����ɫ��ȥ��������ڲ��ָ���
��������H2O2������KI�������·�Ӧ��H2O2+2I-+2H+=I2+2H2O����2Cu2++4I-=2CuI����ɫ����+I2 ���ɵĵ⣬ʹ�ⶨ���ƫ����
�ʴ�Ϊ��ƫ����
��3��������Һ�м����Թ�����30%H2O2��ʹ���ַ�Ӧ��Ŀ��ʹFe2+ת����ȫΪFe3+�����ӷ�Ӧ����ʽΪ��2Fe2++H2O2+2H+=2Fe3++2H2O��Ȼ��ڵμ�NaOH��Һ��������ҺPHԼΪ5����3.2��pH��5.9����ʹFe3+������ȫ��Ȼ��۹��ˣ��٢�����Һ�еμ�1.0molL-1NaOH��������ҺPHԼΪ10����8.9��pH��11����ʹZn2+������ȫ������900�����գ��Ƶ�����п��
�ʴ�Ϊ��������Һ�м����Թ�����30%H2O2��ʹ���ַ�Ӧ�����μ�1.0molL-1NaOH��������ҺPHԼΪ5����3.2��pH��5.9����������Һ�еμ�1.0molL-1NaOH��������ҺPHԼΪ10����8.9��pH��11����