��Ŀ����
����Ŀ����ϩ����Ҫ����ԭ�ϣ��������һ������ʯ�ͻ���ˮƽ�ı�־��ͨ��ʯ���ѽ���Ի����ϩ��������ϩΪԭ�ϻ����Ժϳɺܶ�Ļ�����Ʒ����֪��ϩ�ܷ�������ת����
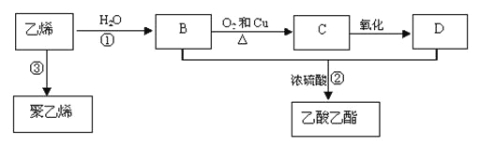
��1����ϩ�Ľṹ��ʽΪ ��
��2����Ӧ���ķ�Ӧ������ ��D�к�����������Ϊ ��
��3��д�����·�Ӧ�Ļ�ѧ����ʽ��[x�� ���� ���� ��
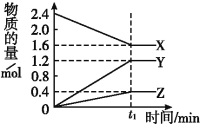
��4����ϩ�������������������飬����������Ҫ�����֣�
����һ��![]()
���ն���![]()
������ɫ��ѧ��ԭ�����������������ԭ�Ӿ����Ժõķ�Ӧ����ʵ�������У�Ӧ����___________����������һ���������ն������������������á�
���𰸡���1��CH2=CH2
��2���ӳɷ�Ӧ���Ȼ�
��3��CH2=CH2+H2O ![]() CH3CH2OH
CH3CH2OH
C2H5OH+CH3COOH![]() CH3COOC2H5+H2O
CH3COOC2H5+H2O
![]()
��4�����ն�
��������
�����������ϩ�����Ӿ۷�Ӧ�õ�����ϩ����ϩ��ˮ�����ӳɷ�Ӧ����BΪCH3CH2OH���Ҵ���Cu�����������·���������Ӧ����CΪCH3CHO��CH3CHO�ɽ�һ�������õ�DΪCH3COOH��CH3CH2OH��CH3COOH��Ũ���������·���������Ӧ����CH3COOCH2CH3����1����ϩ����̼̼˫�����ṹ��ʽΪCH2=CH2���ʴ�Ϊ��CH2=CH2����2����Ӧ������ϩ��ˮ�����ӳɷ�Ӧ�����Ҵ���DΪCH3COOH��������������Ϊ���Ȼ����ʴ�Ϊ���ӳɷ�Ӧ���Ȼ�����3����Ӧ����ϩ��ˮ�ӳɷ�Ӧ�����Ҵ�����Ӧ�ķ���ʽΪCH2=CH2+H2O ![]() CH3CH2OH��
CH3CH2OH��
��Ӧ���Ҵ������ᷢ��������Ӧ����������������Ӧ�ķ���ʽΪC2H5OH+CH3COOH![]() CH3COOC2H5+H2O����Ӧ����ϩ���Է����Ӿ۷�Ӧ���ɾ���ϩ����ӦΪ��
CH3COOC2H5+H2O����Ӧ����ϩ���Է����Ӿ۷�Ӧ���ɾ���ϩ����ӦΪ��![]() ��4���ɷ�Ӧ�����֪�����ն�ԭ��������Ϊ100%����ʵ�������У�Ӧ���ù��ն��������������ã��ʴ�Ϊ�����ն���
��4���ɷ�Ӧ�����֪�����ն�ԭ��������Ϊ100%����ʵ�������У�Ӧ���ù��ն��������������ã��ʴ�Ϊ�����ն���

����Ŀ����������ۺ����ü������ڽ�Լ��Դ���������ڱ���������ʵ�������÷����ɵ�ص�ͭñ��Zn��Cu�ܺ���ԼΪ99%������ͭ���Ʊ�ZnO�IJ���ʵ�����������
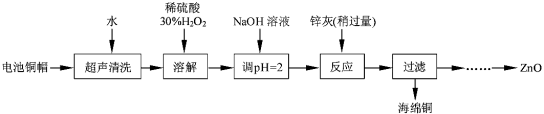
��1����д��ͭñ�ܽ������з�����Ӧ�Ļ�ѧ����ʽ ��
��ͭñ�ܽ���轫��Һ�й���H2O2��ȥ����ȥH2O2�ļ�㷽���� ��
��2��Ϊȷ������п������Ҫ�ɷ�ΪZn��ZnO������Ϊ��������������������ʵ������ⶨ��ȥH2O2����Һ��Cu2���ĺ�����ʵ�����Ϊ��ȷ��ȡһ������ĺ���Cu2������Һ�ڴ�����ƿ�У�������ˮϡ�ͣ�����pH=3��4���������KI����Na2S2O3����Һ�ζ����յ㡣���������е����ӷ���ʽ���£�
2Cu2����4I��=2CuI����ɫ������I2 I2��2![]() =2I����
=2I����![]()
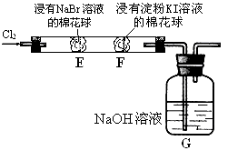
���ζ�ѡ�õ�ָʾ��Ϊ ���ζ��յ�۲쵽������Ϊ ��
�����ζ�ǰ��Һ��H2O2û�г�������������Cu2���ĺ������� ���ƫ�ߡ�����ƫ�͡��������䡱����
��3����֪pH��11ʱZn��OH��2������NaOH��Һ����[Zn��OH��4]2�����±��г����������������������������pH����ʼ������pH����������Ũ��Ϊ1.0 mol��L��1������
Fe3�� | Fe2�� | Zn2�� | |
��ʼ������pH | 1.1 | 5.8 | 5.9 |
��ȫ������pH | 3.2 | 8.8 | 8.9 |
ʵ���п�ѡ�õ��Լ���30% H2O2��1.0 mol��L��1HNO3��1.0 mol��L��1 NaOH��
������ͭ������Һ�Ʊ�ZnO��ʵ�鲽������Ϊ��
�� ��
�� ��
�� ���ˣ�
�� ��
�� ���ˡ�ϴ�ӡ�����
�� 900�����ա�