��Ŀ����
����Ŀ����Ҫ����գ�
(1)��______ molAl2(SO4)3�к�0.3molSO42- ����Al3+Լ_______________����
(2)����£�11.2LNH3������Ϊ��____________g��
(3)20gij���۽����Ȼ��ACl2���к���0.4mol Cl-����ACl2��Ħ��������_________��
(4)��100mLFe2(SO4)3��Һ�к�Fe3+11.2 g������Һ��Fe3+Ũ��____________��ȡ����Һ25ml��ˮϡ����300mL�����ʱϡ��Һ��SO42�������ʵ���Ũ��Ϊ____________��
(5)�ڱ���£�22.4L�ɵ�����������ɵĻ�����壬������Ϊ30g��������������Ϊ______g��
���𰸡�0.1 1.204��1023 8.5 100g/mol 2mol/L 0.25mol/L 16
��������
���ù�ʽn=![]() =
=![]() =
=![]() ��������֮��Ĺ�ϵ���м��㡣
��������֮��Ĺ�ϵ���м��㡣
(1)1Ħ�� Al2(SO4)3�к���3molSO42-����0.3molSO42-ʱ��Al2(SO4)3�����ʵ���Ϊ0.1mol����Al3+0.2mol��Լ0.2mol��6.02��1023������1.204��1023����
(2)n��NH3��=![]() =
=![]() =0.5mol��m=0.5mol��17g/mol=8.5g��
=0.5mol��m=0.5mol��17g/mol=8.5g��
(3)һ��ACl2�к���2Cl-����0.4mol Cl-ʱ��ACl2���ʵ���Ϊ0.2mol��M��ACl2��=![]() =100g/mol��
=100g/mol��
(4) 11.2 g Fe3+�����ʵ���=![]() =0.2mol��c��Fe3+��=
=0.2mol��c��Fe3+��= ![]() =
=![]() =2mol/L����Һϡ��ʱ�����ʵ����ʵ������䣬���������У�N��Fe3+����N��SO42����=2��3����c��SO42����=3mol/L��c1��SO42������300mL=3mol/L��25mL����c1��SO42����=0.25mol/L��
=2mol/L����Һϡ��ʱ�����ʵ����ʵ������䣬���������У�N��Fe3+����N��SO42����=2��3����c��SO42����=3mol/L��c1��SO42������300mL=3mol/L��25mL����c1��SO42����=0.25mol/L��
(5) ����£�22.4L�������������ܵ����ʵ���Ϊ1mol����������ƽ��Ħ������M=![]() =
=![]() =30g/mol����ʮ�ֽ��淨��
=30g/mol����ʮ�ֽ��淨��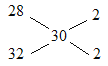 ��n��N2����n��O2��=1��1��n��O2��=0.5mol��������Ϊ0.5mol��32g/mol=16g��
��n��N2����n��O2��=1��1��n��O2��=0.5mol��������Ϊ0.5mol��32g/mol=16g��