题目内容
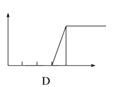
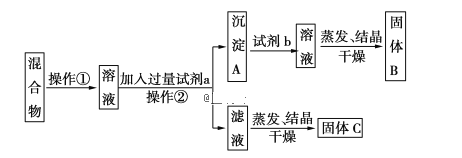
【题目】将一定质量的Mg-Al合金投入100mL一定物质的量浓度的HCl溶液中,充分反应。向反应后的溶液中逐滴加入一定物质的量浓度的NaOH溶液,生成沉淀的质量与所加NaOH溶液的体积关系如下图。回答下列问题:
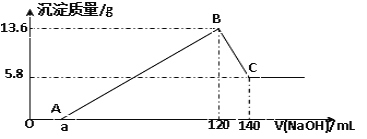
(1)写出OA段和BC段反应的离子方程式: OA:___________ ; BC:___________;
(2)原NaOH溶液的物质的量浓度是多少________?
(3)原Mg-Al合金的质量是多少________g?
【答案】H++OH═H2O Al(OH)3+OH═AlO2+H2O 5mol/L 5.1
【解析】
(1)由图可知,OA段没有沉淀生成,说明原溶液中盐酸溶解Mg、Al后盐酸有剩余,此时发生的反应为:HCl+NaOH=NaCl+H2O;BC段是氢氧化铝与氢氧化钠反应生成偏铝酸钠与水,发生反应Al(OH)3+NaOH=NaAlO2+2H2O;
(2)根据Al(OH)3的两性可计算NaOH的浓度;
(3)由图可知,氢氧化镁的质量为5.8g(0.1mol),故氢氧化铝沉淀质量为13.6g-5.8g=7.8g(0.1mol),根据质量守恒定律可计算出Mg与Al的质量;
(1)由图可知,OA段没有沉淀生成,说明原溶液中盐酸溶解Mg、Al后盐酸有剩余,此时发生的反应为:HCl+NaOH=NaCl+H2O,离子方程式为:H++OH═H2O;BC段是氢氧化铝与氢氧化钠反应生成偏铝酸钠与水,发生反应Al(OH)3+NaOH=NaAlO2+2H2O,反应离子方程式为:Al(OH)3+OH═AlO2+H2O,
故答案为:H++OH═H2O;Al(OH)3+OH═AlO2+H2O;
(2)120~140mL段发生的是Al(OH)3+OH═AlO2+H2O,氢氧化铝为0.1mol,所以消耗氢氧化钠为0.1mol,氢氧化钠溶液体积为:140mL120mL=20mL,故该氢氧化钠溶液的浓度为:c(NaOH)=![]() =5mol/L,
=5mol/L,
故答案为:5mol/L;
(3)由图可知,氢氧化镁的质量为5.8g,故氢氧化铝沉淀质量为:13.6g5.8g=7.8g,混合物中Mg的物质的量为:![]() =0.1mol,Al物质的量为:
=0.1mol,Al物质的量为:![]() =0.1mol,则原MgAl合金的质量是0.1×(24+27)=5.1g,
=0.1mol,则原MgAl合金的质量是0.1×(24+27)=5.1g,
故答案为:5.1;