题目内容
【题目】某学习小组设计以下的实验方案,测定镁铝合金中铝的质量分数。
方案一:将m1g镁铝合金中溶解在足量的试剂X中,充分反应后,过滤、洗涤、干燥、称量,得到质量为m2 g的固体。
(1)试剂X是_____,反应的离子方程式是____;
(2)如果在实验的过程中,没有对固体进行洗涤,则测得铝的质量分数将_____(填“偏大”“偏小”或“无影响”)。
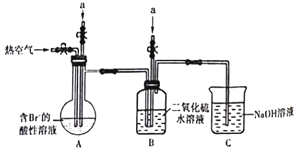
方案二:选择如图所示的装置和药品。

(3)组装完仪器以后,需要进行的实验操作是_____;
(4)导管a的作用是______;
(5)读数时需要注意的事项有_____;
(6)如果合金的质量是a g,测得气体的体积为b L(已换算为标准状况时的体积),则合金中铝的质量分数是_____。
【答案】NaOH 2Al + 2OH-+ 2H2O =2AlO2-+ 3H2↑ 偏小 检查装置的气密性 平衡气压,使液体顺利流下 冷却至室温,液面相平 ![]()
【解析】
根据铝和氢氧化钠反应而镁不和氢氧化钠反应进行设计实验进行分离,也可以利用二者都和酸反应测定氢气的体积从而计算。
(1)根据只有铝能溶于氢氧化钠NaOH,而镁不能和氢氧化钠反应,将合金溶于氢氧化钠溶液中,最后得到的固体为金属镁。反应的离子方程式为:2Al + 2OH-+ 2H2O =2AlO2-+ 3H2↑;
(2)如果固体没有洗涤,会造成金属镁的质量增加,则铝的质量分数偏小;
(3).因为实验中要测定气体的体积,所以组装完应检查装置的气密性;
(4).锥形瓶中反应生成气体,压强变化,用导管a连接锥形瓶和分液漏斗,能平衡气压,使液体顺利流下;
(5)读数应注意测定室温常压情况下的气体体积,所以需要冷却至室温,液面相平,使两侧的气体的压强相同;
(6).根据方程式分析,Mg-H2 , 2Al-3H2 假设镁的物质的量为xmol,铝的物质的量为ymol,则有24x+27y=a,x+1.5y=b/22.4 ,y=![]() ,则铝的质量分数为
,则铝的质量分数为![]() 。
。

 尖子生新课堂课时作业系列答案
尖子生新课堂课时作业系列答案 英才计划同步课时高效训练系列答案
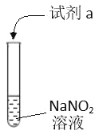
英才计划同步课时高效训练系列答案【题目】利用下列实验探究亚硝酸钠(NaNO2)的化学性质(AgNO2是淡黄色难溶于水的固体)
实验 | 装置 | 试剂a | 现象 |
① |
| 酚酞 | 无色溶液变红 |
② | AgNO3溶液 | 产生淡黄色沉淀 | |
③ | 淀粉KI 溶液+稀硫酸 | 无色溶液立即变蓝 | |
④ | 酸性K2Cr2O7溶液 | 无色溶液变为绿色 |
由上述实验所得结论不正确的是
A.NaNO2溶液呈碱性:NO2-+H2OHNO2+OH-
B.NaNO2可与某些盐发生复分解反应:NO2-+Ag+=AgNO2↓
C.NaNO2有氧化性:2I-+2H++2NO2-=I2+2NO2↑+H2O
D.NaNO2有还原性:Cr2O72-+3NO2-+8H+=3NO3-+2Cr3++4H2O