题目内容
17.按要求填空(1)氯化铁水溶液常温时pH<7(填>或=或<),把氯化铁溶液蒸干,灼烧,最后得到的固体产物是Fe2O3.
(2)用离子方程式表示泡沫灭火器灭火原理:3HCO3-+Al3+=Al(OH)3↓+3CO2↑.
(3)用标准的NaOH溶液滴定未知浓度的盐酸:选用酚酞为指示剂,造成测定结果偏高的是CD.
A.滴定终点读数时,俯视滴定管的刻度,其它操作均正确
B.盛装未知液的锥形瓶用蒸馏水洗过,未用待测液润洗
C.滴定到终点读数时发现滴定管尖嘴处悬挂一滴溶液
D.未用标准液润洗碱式滴定管
E.量取未知液的滴定管水洗后误用标准液润洗
(4)25℃下,某Na2SO4溶液中c(SO42-)=5×10-4 mol•L-1,取该溶液1mL,加水稀释至10mL,则稀释后溶液中c (Na+):c (OH-)=1000:1.
分析 (1)FeCl3是强酸弱碱盐,加热过程中发生水解生成Fe(OH)3和HCl,HCl具有挥发性,加热促进氯化氢挥发,从而促进氯化铁水解,蒸干时得到固体Fe(OH)3,灼烧Fe(OH)3得到Fe2O3,据此分析解答;
(2)泡沫灭火器灭火的原理为硫酸铝和碳酸氢钠发生互促水解生成二氧化碳气体;
(3)根据c(待测)=$\frac{c(标准)V(标准)}{V(待测)}$分析不当操作对V(标准)×的影响,以此判断浓度的误差;
(4)硫酸钠溶液是显中性的,c(OH-)=10-7mol/L.
解答 解:FeCl3是强酸弱碱盐,加热过程中发生水解生成Fe(OH)3和HCl,反应方程式为FeCl3+3H2O?Fe(OH)3+3HCl,溶液显酸性,溶液PH<7,HCl具有挥发性,加热促进氯化氢挥发,从而促进氯化铁水解,蒸干时得到固体Fe(OH)3,灼烧Fe(OH)3得到Fe2O3,反应方程式为2Fe(OH)3$\frac{\underline{\;\;△\;\;}}{\;}$Fe2O3+3H2O,所以最终得到的固体是Fe2O3,
故答案为:<;Fe2O3;
(2)泡沫灭火器灭火的原理为硫酸铝和碳酸氢钠发生互促水解生成二氧化碳气体,反应的离子方程式为Al3++3HCO3-═3CO2↑+Al(OH)3↓,
故答案为:Al3++3HCO3-═3CO2↑+Al(OH)3↓;
(3)A、滴定终点读数时,俯视滴定管的刻度,其它操作均正确,导致V(标准)偏小,结果偏低,故A错误;
B、盛装未知液的锥形瓶用蒸馏水洗过,未用待测液润洗,待测液的物质的量不变,标准液的体积不变,结果不变,故B错误;
C、滴定到终点读数时发现滴定管尖嘴处悬挂一滴溶液,造成消耗的V(标准)偏大,根据c(待测)=$\frac{c(标准)V(标准)}{V(待测)}$,可知C(待测)偏大,故C正确;
D、碱式滴定管未润洗就装标准液滴定,造成消耗的V(标准)偏大,根据c(待测)=$\frac{c(标准)V(标准)}{V(待测)}$,可知C(待测)偏大,故D正确;
E.量取未知液的滴定管水洗后误用标准液润洗,消耗未知液,得到溶液中溶质减少,测定结果偏低,故E错误;
故答案为:C D;
(4)25℃时,某Na2SO4溶液中c(SO42-)=5×10-4 mol/L,则溶液中钠离子浓度是1×10-3 mol/L.如果稀释10倍,则钠离子浓度是1×10-4 mol/L.但硫酸钠溶液是显中性的,c(OH-)=10-7mol/L,所以c(Na+):c(OH-)=10-4:10-7=1000:1,
故答案为:1000:1.
点评 本题考查了水的电离、水的离子积常数和pH的有关计算、弱电解质的电离平衡以及离子浓度大小比较,题目难度中等,本题是基础性知识的考查,主要是巩固学生对教材基础知识的理解掌握程度,提高学生的解题能力.

 阅读快车系列答案
阅读快车系列答案| A. | 5.6g铁粉与足量Cl2反应,失去的电子数为0.2NA | |
| B. | 1.8g重水(D2O)中含有的质子数和电子数均为1.0NA | |
| C. | 5NH4NO3$\frac{\underline{\;\;△\;\;}}{\;}$2HNO3+4N2↑+9H2O反应中,生成28g N2时,转移的电子数目为3.75NA | |
| D. | 常温下,2.7g铝片投入足量的浓硫酸中,铝失去的电子数为0.3NA |
| A. | 金属,化合物 | B. | 单质,纯净物 | ||
| C. | 石灰乳,胶体 | D. | 过氧化钠,碱性氧化物 |
| A. | 加入铝粉有大量氢气产生的溶液中:Mg2+、K+、NO3-、SiO32- | |
| B. | 在0.1mol/L氢氧化钠的溶液中:Na+、K+、Cr2O72-、S2- | |
| C. | 在0.1mol/L的醋酸溶液中:Fe2+、Na+、ClO-、Ca2+ | |
| D. | 在0.1mol/L的硝酸溶液中:NH4+、Ca2+、Cl-、K+ |
 ;
;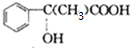 $\stackrel{一定条件下}{→}$
$\stackrel{一定条件下}{→}$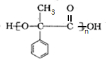 +(n-1)H2O.
+(n-1)H2O.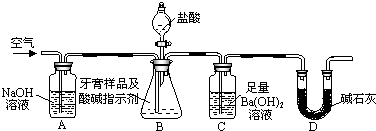
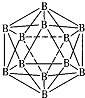 硼(B)、铝(Al)、镓(Ga)均属于硼族元素(第ⅢA族),它们的化合物或单质都有重要用途.回答下列问题:
硼(B)、铝(Al)、镓(Ga)均属于硼族元素(第ⅢA族),它们的化合物或单质都有重要用途.回答下列问题: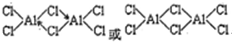 ;
;