题目内容
8.设NA为阿伏加德罗常数的值,下列有关叙述正确的是( )| A. | 5.6g铁粉与足量Cl2反应,失去的电子数为0.2NA | |
| B. | 1.8g重水(D2O)中含有的质子数和电子数均为1.0NA | |
| C. | 5NH4NO3$\frac{\underline{\;\;△\;\;}}{\;}$2HNO3+4N2↑+9H2O反应中,生成28g N2时,转移的电子数目为3.75NA | |
| D. | 常温下,2.7g铝片投入足量的浓硫酸中,铝失去的电子数为0.3NA |
分析 A、求出铁粉的物质的量,然后根据铁与氯气反应后变为+3价来分析;
B、求出重水的物质的量,然后根据1mol重水中含10mol电子和10mol质子来分析;
C、此反应转移15mol电子,生成4mol氮气;
D、常温下,铝在浓硝酸中钝化.
解答 解:A、5.6g铁粉的物质的量为0.1mol,而铁与氯气反应后变为+3价,故0.1mol铁失去0.3mol电子即0.3NA个,故A错误;
B、重水的摩尔质量为20g/mol,故18g重水的物质的量为0.9mol,而1mol重水中含10mol电子和10mol质子,故0.9mol重水中含9mol电子和9mol质子,故B错误;
C、28g氮气的物质的量n=$\frac{28g}{28g/mol}$=1mol,此反应转移15mol电子,生成4mol氮气,故当生成1mol氮气时,转移3.75mol电子即3.75NA个电子,故C正确;
D、常温下,铝在浓硝酸中钝化,不能完全反应,故转移的电子的个数小于0.3NA个,故D错误.
故选C.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.

练习册系列答案
 一课四练系列答案
一课四练系列答案 黄冈小状元满分冲刺微测验系列答案
黄冈小状元满分冲刺微测验系列答案 新辅教导学系列答案
新辅教导学系列答案 阳光同学一线名师全优好卷系列答案
阳光同学一线名师全优好卷系列答案
相关题目
13.下列离子方程式正确的是( )
| A. | 铜粉溶于FeCl3溶液的离子方程式:Cu+Fe3+=Cu2++Fe2+ | |
| B. | 将Na2O2固体投入H218O中:2H218O+2Na2O2═4OH-+4Na++18O2↑ | |
| C. | 向NH4Al(SO4)2溶液中滴入Ba(OH)2溶液恰好使SO42-完全沉淀:2Ba2++NH4++Al3++2SO42-+4OH-═Al(OH)3↓+NH3•H2O+2BaSO4↓ | |
| D. | Ca(HCO3)2溶液与足量NaOH溶液反应:HCO3-+Ca2++OH-═CaCO3↓+H2O |
20.俄国化学家门捷列夫为化学的发展做出过十分重要的贡献,在前人研究的基础上,他于1869年提出了( )
| A. | 原子学说 | B. | 分子学说 | C. | 等电子体学说 | D. | 元素周期律 |
18.根据下表信息,判断以下叙述正确的是( )
| 元素代号 | L | M | Q | R | T |
| 原子半径/nm | 0.160 | 0.143 | 0.089 | 0.102 | 0.074 |
| 主要化合价 | +2 | +3 | +2 | +6、-2 | -2 |
| A. | 氢化物的沸点:H2T<H2R | B. | M与T形成的化合物具有两性 | ||
| C. | 单质与稀盐酸反应的速率:L<Q | D. | L2+与R2-的核外电子数相等 |

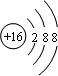 ;A与C组成的化合物电子式为
;A与C组成的化合物电子式为 .
.