题目内容
【题目】再生铅行业是我国在重视环境保护和充分利用有色金属再生资源的情况下逐步发展起来的新兴产业。从废旧铅蓄电池中回收铅的工艺为:
![]()
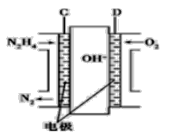
电解原理如图所示。下列说法正确的是
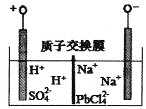
A. 阴极区电极反应式为:2H++2e-=H2↑
B. 电解过程中阳极附近pH明显增大
C. Na2PbCl4浓度下降后,在阴极区加入PbO,可实现电解质溶液的再生使用
D. 电路中流经4mol电子,阴极可得207g铅
【答案】C
【解析】
该装置为电解池,与电源正极相连的电极为阳极,与电源负极相连的电极为阴极,阴极发生还原反应,电极反应式为PbCl42-+2e-=Pb+4Cl-,阳极发生氧化反应,电极反应式为:2H2O-4e-=O2↑+4H+,据此分析解答。
A.由上述分析可知,阴极区发生还原反应,电极反应式为PbCl42-+2e-=Pb+4Cl-,故A错误;
B.阳极的电极反应式为2H2O-4e-=O2↑+4H+,阳极区氢离子浓度增大,所以阳极附近pH减小,故B错误;
C.阴极电解一段时间后溶液为HCl和NaCl的混合溶液,根据流程图,将PbO粗品溶解在HCl和NaCl的混合溶液中,得到含Na2PbCl4的电解液,且根据电极反应式可知电解后减少的元素有Pb、O,因此向阴极区加PbO可恢复其浓度且实现物质的循环利用,故C正确;
D.电解Na2PbCl4溶液,阴极生成Pb,电极反应式为PbCl42-+2e-=Pb+4Cl-,所以n(Pb)=![]() n(e-)=2mol,m(Pb)=2mol×207g/mol=414g,故D错误;
n(e-)=2mol,m(Pb)=2mol×207g/mol=414g,故D错误;
故选C。

练习册系列答案
 孟建平小学滚动测试系列答案
孟建平小学滚动测试系列答案
相关题目