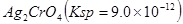题目内容
向50 mL 0.018 mol/L的AgNO3溶液中加入50 mL 0.02 mol/L的盐酸生成沉淀。已知:Ksp(AgCl)=1.8×10-10 mol2·L-2,则生成沉淀后的溶液中c(Ag+)与pH分别为
| A.1.8×10-7 mol/L,2 | B.1×10-7 mol/L,2 | C.1.8×10-7 mol/L,3 | D.1×10-7 mol/L,3 |
A
硝酸银是0.0009mol,氯化氢是0.001mol,所以盐酸是过量的,反应后溶液中氯离子的物质的量是0.0001mol,浓度是0.0001mol÷0.1L=0.001mol/L,因此根据溶度积常数表达式可知,生成沉淀后的溶液中c(Ag+)=1.8×10-10 mol2·L-2÷0.001mol/L=1.8×10-7 mol/L。由于在反应中氢离子的物质的量是不变的,所以反应后溶液中氢离子浓度是0.001mol÷0.1L=0.01mol/L,因此pH=2,答案选A。

练习册系列答案
 寒假学与练系列答案
寒假学与练系列答案
相关题目
 Cu2+(aq)+2OH-(aq),在常温下,Ksp=2×10-20。某CuSO4溶液中,c(Cu2+)=0.02 mol·L-1,在常温下如果要生成Cu(OH)2沉淀,需要向CuSO4溶液加入碱溶液来调整pH,使溶液的pH大于( )
Cu2+(aq)+2OH-(aq),在常温下,Ksp=2×10-20。某CuSO4溶液中,c(Cu2+)=0.02 mol·L-1,在常温下如果要生成Cu(OH)2沉淀,需要向CuSO4溶液加入碱溶液来调整pH,使溶液的pH大于( ) 浓度最大的是
浓度最大的是