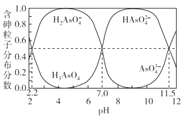
题目内容
【题目】实验室以废铜为原料制取碱式碳酸铜(Cu2(OH)2CO3)的过程如下:
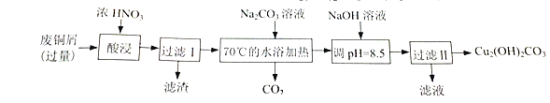
完成下列填空:
(1)酸浸中产生的气体是_________(填化学式)。
(2)检验过滤Ⅱ的沉淀是否洗净的方法是________。
(3)从实验流程中可看出影响产品生成的因素有多种,请写出其中两个:___________, 并任选其中一个因素,说明其原因___________。
(4)CuSO4溶液和纯碱溶液混合同样也可以制得Cu2(OH)2CO3,写出该反应的化学方程式:______。
(5)产品中Cu含量的测定步骤是:称取mg样品,用适量稀硫酸完全溶解,加水稀释,调节溶液为中性或弱酸性,再加入过量的KI-淀粉溶液后,用c mol/L的Na2S2O3溶液滴定至终点,消耗Na2S2O3溶液v mL。实验中反应的离子方程式为2Cu2++4I-→2CuI(白色)↓+I2;I2+2S2O32-→2I-+S4O62-。
(i)样品溶于稀硫酸后,需加水稀释,控制溶液为中性或弱酸性,其原因是________。
(ii)产品中Cu的含量为__________________(用含m、c、v的代数式表示)。
【答案】NO、NO2 取最后一次洗涤液测其pH,若溶液为中性,则沉淀已洗净 温度和pH(反应物浓度、反应物配比等合理答案也得分) 温度过高,碱式碳酸铜会分解生成氧化铜,温度过低,反应速率太慢(或:pH过低,得不到碱式碳酸铜,pH过高则生成氢氧化铜)。 2CuSO4+2Na2CO3+H2O→Cu2(OH)2CO3↓+2Na2SO4+CO2↑ 若溶液酸性过强,则2H++S2O32-→S↓+SO2+H2O,多消耗Na2SO3溶液 0.064cv/m
【解析】
废铜屑溶于浓硝酸中转化为硝酸铜,过滤除去滤渣,向滤液中加入碳酸钠溶液,除去多余的硝酸,然后加入氢氧化钠溶液调节pH生成碱式碳酸铜,据此解答。
(1)酸浸中铜与浓硝酸反应生成二氧化氮(NO2),随着浓度的降低,会产生一氧化氮(NO),
故答案为:NO、NO2;
(2)根据流程分析可知,碱式碳酸铜是从含有碳酸钠的溶液中析出的,所以检验沉淀是否洗净就是检验沉淀上有没碳酸根离子,操作方法是取最后一次洗涤液滴加氯化钡溶液,若溶液中没有出现沉淀,则沉淀已洗净,
故答案为:取最后一次洗涤液滴加氯化钡溶液,若溶液中没有出现沉淀,则沉淀已洗净;
(3)从实验流程中可看出温度过高,碱式碳酸铜会分解生成氧化铜,温度过低,反应速率太慢,pH过低,得不到碱式碳酸铜,pH过高则生成氢氧化铜,所以影响产品生成的因素有温度和pH,
故答案为:温度和pH;温度过高,碱式碳酸铜会分解生成氧化铜,温度过低,反应速率太慢,或:pH过低,得不到碱式碳酸铜,pH过高则生成氢氧化铜;
(4)CuSO4溶液和纯碱溶液混合同样也可以制得Cu2(OH)2CO3,根据元素守恒可知反应的化学方程式为2CuSO4+2Na2CO3+H2O→Cu2(OH)2CO3↓+2Na2SO4+CO2↑,
故答案为:2CuSO4+2Na2CO3+H2O→Cu2(OH)2CO3↓+2Na2SO4+CO2↑;
(5)①样品溶于稀硫酸后,需加水稀释,控制溶液为中性或弱酸性,若溶液酸性过强,则2H++S2O32-→S↓+SO2+H2O,多消耗Na2S2O3溶液,
故答案为:若溶液酸性过强,则2H++S2O32-→S↓+SO2+H2O,多消耗Na2SO3溶液;
②根据反应2Cu2++4I-→2CuI(白色)↓+I2、I2+2S2O32-→2I-+S4O62-可得关系式Cu2+~S2O32-,根据题意可知,Na2S2O3的物质的量为cv×10-3mol,所以样品中铜元素的质量为0.064cvg,进而确定产品中Cu的含量为0.064cv/m,
故答案为:0.064cv/m。

【题目】下列根据操作和现象所得出的结论正确的是( )
选项 | 实验操作及现象 | 实验结论 |
A | 向KI溶液中加入30%H2O2、稀硝酸及淀粉溶液,溶液变蓝 | H2O2氧化性比I2强 |
B | 向Na2CO3溶液中加稀硫酸将产生的气体通入硅酸钠溶液中产生白色沉淀 | 非金属性:S>C>Si |
C | 向某溶液中滴加稀NaOH溶液时,将湿润的红色石蕊试纸置于试管口,试纸不变蓝 | 原溶液不含NH4+ |
D | 将BaSO4浸泡在饱和Na2CO3溶液中,一段时间后过滤并洗涤沉淀,向沉淀中加入稀盐酸,有气泡产生 | Ksp(BaSO4)>Ksp(BaCO3) |
A.AB.BC.CD.D