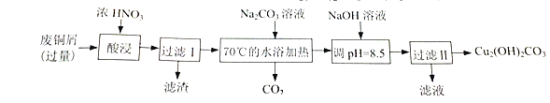
题目内容
【题目】电导率可用于衡量电解质溶液导电能力的大小。室温下,用0.1000mol/L氨水滴定10mL浓度均为0.100 mol/L的盐酸和醋酸的混合液,电导率曲线如图所示。下列说法错误的是

A.①点溶液中c(H+)为0.200 mol/L
B.②点溶液中c(Cl-)>c(NH4+)>c(Ac-)
C.①点溶液中n(所有离子)之和>③点溶液n(所有离子)之和
D.③点后会出现pH=7的点,此点溶液中c(NH4+)=c(Ac-)+c(Cl-)
【答案】AC
【解析】
A. 醋酸是弱酸,在水中只有部分电离,导致氢离子浓度小于醋酸的浓度,所以该混合溶液中氢离子浓度小于0.200mol/L,故A错误;
B. ②点溶液中,溶质为等浓度的醋酸与氯化铵,铵根离子水解浓度会减小,所以c(Cl-)>c(NH4+),则溶液中c(Cl-)>c(NH4+)>c(Ac-),故B正确;
C. ①点溶液中溶质为醋酸和HCl,醋酸部分电离,③点溶液溶质为氯化铵和醋酸铵,二者为强电解质完全电离,所以①点溶液中n(所有离子)之和<③点溶液n(所有离子)之和,故C错误;
D. ③点后会出现pH=7的点,溶液中电荷守恒为c(NH4+)+c(H+)= c(Ac-)+c(Cl-)+c(OH),溶液显中性,则c(H+)=c(OH),所以此点溶液中c(NH4+)=c(Ac-)+c(Cl-),故D正确。
故选:AC。

 黄冈海淀全程培优测试卷系列答案
黄冈海淀全程培优测试卷系列答案【题目】填空:
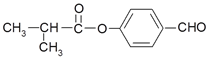
I. 某有机物由C、H、O三种元素组成,球棍模型如图所示:

(1)该有机物的分子式是_____________;
(2)该有机物所含官能团的名称是_____________;
(3)该有机物可以发生加聚反应,其产物的结构简式是_____________;
(4)下列有关该有机物的描述中,正确的是_____________(填序号)。
a. 能与NaHCO3溶液反应 b. 能发生水解反应
c. 不能与溴的CCl4溶液反应 d. 能与酸性高锰酸钾溶液反应
II. 实验室制得气体中常含有杂质,影响其性质检验。下图A为除杂装置,B为性质检验装置,完成下列表格:

序号 | 气体 | 反应原理 | A中试剂 |
① | 乙烯 | 溴乙烷和NaOH的醇溶液加热 | ______________ |
② | 乙烯 | 无水乙醇在浓硫酸的作用下加热至170℃反应的化学方程式是__________ | ______________ |
③ | 乙炔 | 电石与饱和食盐水反应 | ______________ |