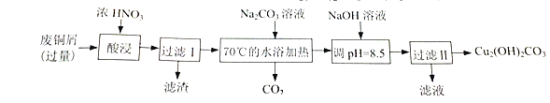
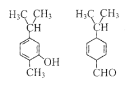
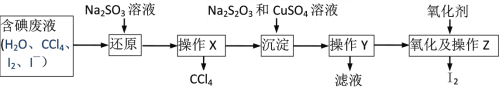
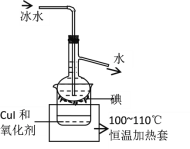
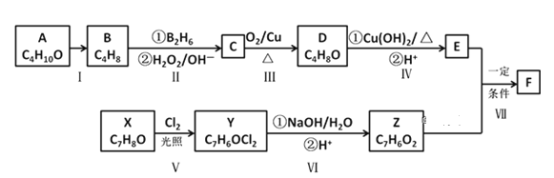
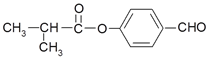
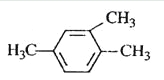
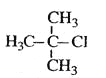题目内容
【题目】下列根据操作和现象所得出的结论正确的是( )
选项 | 实验操作及现象 | 实验结论 |
A | 向KI溶液中加入30%H2O2、稀硝酸及淀粉溶液,溶液变蓝 | H2O2氧化性比I2强 |
B | 向Na2CO3溶液中加稀硫酸将产生的气体通入硅酸钠溶液中产生白色沉淀 | 非金属性:S>C>Si |
C | 向某溶液中滴加稀NaOH溶液时,将湿润的红色石蕊试纸置于试管口,试纸不变蓝 | 原溶液不含NH4+ |
D | 将BaSO4浸泡在饱和Na2CO3溶液中,一段时间后过滤并洗涤沉淀,向沉淀中加入稀盐酸,有气泡产生 | Ksp(BaSO4)>Ksp(BaCO3) |
A.AB.BC.CD.D
【答案】B
【解析】
A.向KI溶液中加入30%H2O2、稀硝酸及淀粉溶液,溶液变蓝,稀硝酸也可以把I-氧化成I2,A错误;
B. 向Na2CO3溶液中加稀硫酸将产生CO2气体,说明硫酸的酸性比碳酸的酸性强,CO2气体通入硅酸钠溶液中产生白色硅酸沉淀,说明碳酸的酸性比硅酸的酸性强,最高价氧化物对应水化物酸性越强,则元素的非金属性越强,B正确;
C.NH4+与OH-在稀溶液不加热的条件下反应生成NH3·H2O,向某溶液中滴加稀NaOH溶液时,将湿润的红色石蕊试纸置于试管口,试纸不变蓝,不能证明溶液中不含NH4+,C错误;
D.将BaSO4浸泡在饱和Na2CO3溶液中,BaSO4(s)![]() Ba2+(aq)+ SO42-(aq),只要c(Ba2+)c(CO32-) >Ksp(BaCO3),就可生成BaCO3沉淀,故不能证明Ksp(BaSO4)>Ksp(BaCO3),D错误;
Ba2+(aq)+ SO42-(aq),只要c(Ba2+)c(CO32-) >Ksp(BaCO3),就可生成BaCO3沉淀,故不能证明Ksp(BaSO4)>Ksp(BaCO3),D错误;
答案选B。

练习册系列答案
相关题目