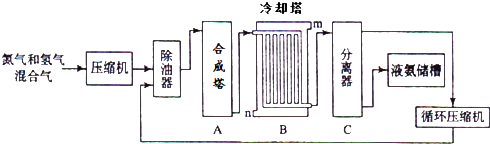
��Ŀ����
����Ŀ��2017��3��21���ǵڶ�ʮ���������ˮ����������ˮ��Դ���������÷�ˮ��ʡˮ��Դ����ǿ��ˮ�Ļ��������ѱ�Խ��Խ���������ע����֪��ij��ɫ��ˮ�п��ܺ���H����NH4+��Fe3����Al3����Mg2����Na����NO3-��CO32-��SO42-�еļ��֣�Ϊ������ɷ֣��ֱ�ȡ��ˮ��Ʒ100mL������������ʵ�飬��������й�ͼ��������ʾ��
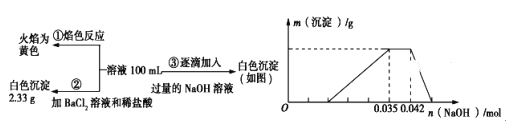
��ش��������⣺
��1����������3��ʵ����Է�����ˮ��һ�������ڵ���������__________��һ�����ڵ���������______________________��
��2��д��ʵ���ͼ���г����ﵽ��������������ٷ����仯�η�����Ӧ�����ӷ�Ӧ����ʽ��_____________________________________________��
��3������ͼ����ԭ��Һ��c(NH4+)��c(Al3��)�ı�ֵΪ___________�����ó��������������_________g��
��4����ͨ��ʵ��ȷ��ԭ��ˮ��c(Na��)=0.14 mol��L-1,���ж�ԭ��ˮ��NO3-�Ƿ���ڣ�__________����������������������������ȷ�������������ڣ�c(NO3-)=____________ mol��L-1�����������ڻ�ȷ����˿ղ��
���𰸡� CO32- Na+��H+��Al3+��NH4+ NH4+ + OH�� = NH3��H2O 1��1 0.546g ���� 0.36 mol��L-1
��������(1)��ɫ��ˮȷ����Fe3+������ʵ���ȷ����Na+������ʵ���ȷ����SO42-������ʵ���ȷ����Al3+��һ������Fe3+��Mg2+����ΪCO32-��Al3+���ܹ��棬������CO32-������Һ�д��ڵ�����Ϊ��Na+��Al3+��NH4+��H+��SO42-����ˮ��һ�������ڵ�������Fe3+��Mg2+��CO32-���ʷ�ˮ��һ�������ڵ���������CO32-��һ�����ڵ���������Na+��Al3+��NH4+��H+��
(2)ʵ���ͼ���г����ﵽ������������μ�NaOH��Һ������Һ���NH4+ ��������NH3��H2O����ʱ�����������ٷ����仯����Ӧ�����ӷ�Ӧ����ʽNH4+ + OH�� = NH3��H2O��
(3)��֪���ᱵ����Ϊ2.33g����n(SO42-)=![]() =0.01mol��
=0.01mol��
����ͼ���֪��Al(OH)3��Ӧ��OH-Ϊ��n(OH-)=0.007mol��
Al(OH)3+OH-=AlO2-+2H2O
n(Al3+) 0.007mol
����n(Al3+)=0.007mol���������ӳ�����Ҫ��������0.021mol��������Һ��H+������������0.014mol�������ӵ����ʵ�����0.014mol��
NH4++OH-=NH3H2O��������������0.007mol������笠����ӵ����ʵ�����0.007mol��ԭ��Һ��c(NH4+)��c(Al3+)�ı�ֵΪ1��1��
����Al(OH)3������Ϊ0.007mol��78g/mol=0.546g��
(4)��Һ�д��ڵ�����Ϊ��Na+��Al3+��NH4+��H+��SO42-����֪���ᱵ����Ϊ2.33g����n(SO42-)=![]() =0.01mol������n(Al3+)=0.007mol��n(H+)=0.014mol��n(NH4+)=0.007mol����Һ�д��ڵ���غ㣬3n(Al3+)+n(H+)+n(NH4+)+n(Na+)=3��0.007mol+0.014mol+0.007mol+0.14 mol��L-1��0.1L=0.056mol��2n(SO42-)=0.02mol����һ������NO3-����n(NO3-)=0.056mol-0.02mol=0.036mol��c(NO3-)=
=0.01mol������n(Al3+)=0.007mol��n(H+)=0.014mol��n(NH4+)=0.007mol����Һ�д��ڵ���غ㣬3n(Al3+)+n(H+)+n(NH4+)+n(Na+)=3��0.007mol+0.014mol+0.007mol+0.14 mol��L-1��0.1L=0.056mol��2n(SO42-)=0.02mol����һ������NO3-����n(NO3-)=0.056mol-0.02mol=0.036mol��c(NO3-)=![]() =0.36mol/L��
=0.36mol/L��

 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�����Ŀ���������������������ά�ء�������ά�ص����ܼ���ʵ���Һϳɼ�����������ķ�Ӧԭ�����й��������£� ![]() +2C2H5OH
+2C2H5OH ![]()
![]() +2H2O
+2H2O
��Է������� | �ܶ�/��gcm��3�� | �е�/�� | ˮ���ܽ��� | |
����������� | 202 | 1.01 | 245 | ������ˮ |
������ | 146 | 1.36 | 231.8 | �� |
�Ҵ� | 46 | 0.79 | 78.4 | ���� |
�ױ� | 92 | 0.87 | 110.6 | ������ˮ |
ʵ�鲽�����£�
����1����50mLԲ����ƿ�м��뼺����1.8g��0.012mol�����Ҵ�4.4mL��0.076mol�����ױ�5mL��Ũ���ᣨ1mL����װ����ͼ��ʾ��С����Ȼ���40min��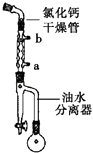
����2����ȴ������װ�ø�Ϊ����װ�ã���ѹ������120�����ҳ������
����3��������2��Һ�嵹�������ƿ�����м�ѹ�������ü����������2.2g��
��1��ͼ������������ȴˮ�����a����b�����ڽ���Ũ�������Ҫ������������ ��
��2������һ��ʱ���ͼ��������������������Ҫ�� ��
��3��ʵ���м���������Ҵ���Ŀ���� ��
��4������2ʵ������ɵı�־�� ��
��5����ʵ��IJ���Ϊ ��
����Ŀ��T�桢2L�ܱ�������ijһ��Ӧ��ͬʱ�̸����ʵ�����ͼ��EΪ���壬����Ϊ���壩���ش��������⣺
��1��д���÷�Ӧ�Ļ�ѧ����ʽ ��
��2����Ӧ��ʼ��3minʱ����D��ʾ��ƽ����Ӧ����Ϊmol/��Lmin����
��3��T��ʱ���÷�Ӧ�Ļ�ѧƽ�ⳣ��K= ��
��4����6minʱ�������¶Ȳ��䣬�������������С��ԭ����һ�룬���´ﵽƽ���D���������Ϊ ��
���� | A | B | D | E |
���ʵ���mol | 0.8 | 1.0 | 0.4 | 0.2 |
��5������һ��2L���ܱ�������T�桢ijһʱ��ʱ�������и����ʵ��������ʾ����ʱv������v���棩������ڡ����ڡ���С�ڡ�����