题目内容
【题目】己二酸二乙酯是乙酸纤维素、硝酸纤维素的增塑剂,实验室合成己二酸二乙酯的反应原理和有关数据如下: ![]() +2C2H5OH
+2C2H5OH ![]()
![]() +2H2O
+2H2O
相对分子质量 | 密度/(gcm﹣3) | 沸点/℃ | 水中溶解性 | |
己二酸二乙酯 | 202 | 1.01 | 245 | 不溶于水 |
己二酸 | 146 | 1.36 | 231.8 | 微溶 |
乙醇 | 46 | 0.79 | 78.4 | 混溶 |
甲苯 | 92 | 0.87 | 110.6 | 不溶于水 |
实验步骤如下:
步骤1:在50mL圆底烧瓶中加入己二酸1.8g(0.012mol),乙醇4.4mL(0.076mol),甲苯5mL和浓硫酸(1mL),装置如图所示,小火加热回流40min.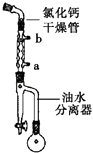
步骤2:冷却,回流装置改为蒸馏装置,常压蒸馏,在120℃左右充分蒸馏.
步骤3:将步骤2的液体倒入克氏烧瓶,进行减压蒸馏,最后得己二酸二乙酯2.2g.
(1)图中冷凝管中冷却水从(填“a”或“b”)口进,浓硫酸的主要作用是作催化剂 .
(2)回流一段时间后,打开图中旋塞,流出的物质主要是 .
(3)实验中加入过量的乙醇的目的是 .
(4)步骤2实验已完成的标志是 .
(5)本实验的产率为 .
【答案】
(1)a;作催化剂
(2)水(或水和乙醇)
(3)提高己二酸的转化率
(4)无馏分蒸出
(5)90.8%
【解析】解:(1.)根据逆流冷却效果好,所以冷却水的进口为a,在己二酸与乙醇发生的酯化反应中浓硫酸作催化剂,所以答案是:a;作催化剂;
(2.)由于水和乙醇的沸点比己二酸二乙酯和己二酸都要低,容易形成蒸汽,并在冷凝管被冷凝而留在油水分离器中,所以回流一段时间后,打开图中旋塞,流出的物质主要是水(或水和乙醇),所以答案是:水(或水和乙醇);
(3.)酯化反应是可逆反应,增加一种反应物可以提高另一种反应物的转化率,所以实验中加入过量的乙醇的目的是提高己二酸的转化率,所以答案是:提高己二酸的转化率;
(4.)步骤2中在120℃左右充分蒸馏,当无馏分蒸出,就可说明蒸馏操作完成,
所以答案是:无馏分蒸出;
(5.)己二酸0.012mol与乙醇0.076mol反应,根据酯化反应的方程式可知,乙醇过量,所以理论上产生己二酸二乙酯的物质的量为0.012mol,即质量为202×0.012g=2.424g,所以己二酸二乙酯的产率= ![]() ×100%=
×100%= ![]() ×100%=90.8%,所以答案是:90.8%.
×100%=90.8%,所以答案是:90.8%.

 名校课堂系列答案
名校课堂系列答案