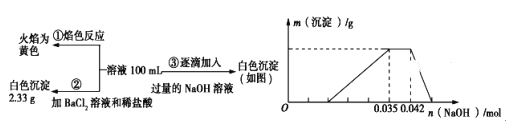
题目内容
【题目】T℃、2L密闭容器中某一反应不同时刻各物质的量如图(E为固体,其余为气体).回答下列问题:
(1)写出该反应的化学方程式 .
(2)反应开始至3min时,用D表示的平均反应速率为mol/(Lmin).
(3)T℃时,该反应的化学平衡常数K= .
(4)第6min时,保持温度不变,将容器的体积缩小至原来的一半,重新达到平衡后,D的体积分数为 .
物质 | A | B | D | E |
物质的量mol | 0.8 | 1.0 | 0.4 | 0.2 |
(5)另有一个2L的密闭容器,T℃、某一时刻时,容器中各物质的量如表所示:此时v(正)v(逆)(填“大于”或“等于”或“小于”). 
【答案】
(1)2A+B ![]() 3D+E
3D+E
(2)0.1mol/(L?min)
(3)![]()
(4)![]()
(5)大于
【解析】解:(1)根据图中的数据可知,AB的物质的量减小,DE物质的量增加,所以AB为反应物,DE为生成物,△n(A):△n(B):△n(D):△n(E)=0.4:0.2:0.6:0.2=2:1:3:1利用各物质变化的物质的量之比等于化学反应计量数之比,可写出化学方程式为2A+B ![]() 3D+E,所以答案是:2A+B
3D+E,所以答案是:2A+B ![]() 3D+E;(2)反应开始至3min时,用D表示的平均反应速率为v=
3D+E;(2)反应开始至3min时,用D表示的平均反应速率为v= ![]() =
= ![]() =0.1mol/(Lmin),所以答案是:0.1mol/(Lmin);(3)根据生成物浓度系数次幂之积除以反应物浓度系数次幂之积计算平衡常数,因为E是固体,所以K=
=0.1mol/(Lmin),所以答案是:0.1mol/(Lmin);(3)根据生成物浓度系数次幂之积除以反应物浓度系数次幂之积计算平衡常数,因为E是固体,所以K= ![]() =
= 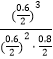 =
= ![]() ;所以答案是:
;所以答案是: ![]() ;(4)在温度不变条件下,反应2A(g)+B(g)
;(4)在温度不变条件下,反应2A(g)+B(g) ![]() 3D(g)+E(s)前后气体体积不变,所以体积压缩为原来一半时,平衡不移动,D的体积分数不变,所以D的体积分数为:
3D(g)+E(s)前后气体体积不变,所以体积压缩为原来一半时,平衡不移动,D的体积分数不变,所以D的体积分数为: ![]() ,所以答案是:0.3;(5)根据表中数据可知,此时Qc=
,所以答案是:0.3;(5)根据表中数据可知,此时Qc= ![]() =
= ![]() <
< ![]() ;即Qc<K 反应未达平衡,要正向移动,所以v(正)>v(逆),所以答案是:大于.
;即Qc<K 反应未达平衡,要正向移动,所以v(正)>v(逆),所以答案是:大于.
【考点精析】利用化学平衡的计算对题目进行判断即可得到答案,需要熟知反应物转化率=转化浓度÷起始浓度×100%=转化物质的量÷起始物质的量×100%;产品的产率=实际生成产物的物质的量÷理论上可得到产物的物质的量×100%.

 开心蛙状元测试卷系列答案
开心蛙状元测试卷系列答案