题目内容
20.现有下列物质:①Na2CO3•10H2O晶体 ②锌 ③氯化氢 ④CO2⑤NaHSO4固体 ⑥Ba(OH)2固体⑦红褐色的氢氧化铁液体 ⑧氨水 ⑨稀硫酸 ⑩熔融NaCl⑪蔗糖(1)按物质的分类方法填写表格的空白处 (填编号):
| 分类标准 | 能导电的物质 | 电解质 | 非电解质 |
| 属于该类的物质 | ②⑦⑧⑨⑩ | ①③⑤⑥⑩ | ④⑪ |
(3)将⑨滴加到⑦中至过量的实验现象是先产生沉淀后溶解.
(4)将③通入⑧中至恰好完全反应,则溶液导电能力的变化为导电能力逐渐增强.
分析 (1)能导电的物质必须含有自由电子或自由离子;
电解质是指:在水溶液里或熔融状态下能导电的化合物.该定义的前提必须是化合物;
非电解质是指:在水溶液里或熔融状态下都不能导电的化合物.该定义的前提必须是化合物;
(2)H++OH-=H2O表示强酸与强碱反应生成可溶性盐和水的离子反应;
(3)胶体加入电解质会发生聚沉,氢氧化铁胶体逐滴加入稀硫酸溶液,先发生聚沉产生氢氧化铁沉淀,然后氢氧化铁与酸发生酸碱中和反应生成可溶性硫酸铁和水;
(4)电解质溶液导电能力强弱取决于离子浓度的大小,一水合氨为弱电解质,氨水中与HCl反应生成强电解质氯化铵.
解答 解:(1)①Na2CO3•10H2O晶体中不含自由移动的电子或离子,不导电; Na2CO3•10H2O晶体是化合物,在水溶液或者熔融状态下都能导电,属于电解质;
②锌是金属含有自由电子,能导电;锌是单质,既不是电解质也不是非电解质;
③氯化氢中只存在分子,没有自由移动的离子或者电子,不导电;氯化氢是化合物,溶液水能电离出自由移动的离子而导电,属于电解质;
④CO2只存在分子,没有自由移动的离子或者电子,不导电;二氧化碳是化合物,溶于水生成碳酸溶液导电,但是二氧化碳分子本身不能电离,属于非电解质;
⑤NaHSO4固体不含自由移动的电子或离子,不导电;NaHSO4固体是化合物,NaHSO4在水溶液或者熔融状态下都能导电,属于电解质;
⑥Ba(OH)2固体不含自由移动的电子或离子,不导电;Ba(OH)2固体是化合物,在熔融状态下能导电,属于电解质;
⑦红褐色的氢氧化铁液体含自由移动的离子,能导电;氢氧化铁液是混合物,既不是电解质也不是非电解质;
⑧氨水含自由移动的离子,能导电;氨水是混合物,既不是电解质也不是非电解质;
⑨稀硫酸含自由移动的离子,能导电;稀硫酸是混合物,既不是电解质也不是非电解质;
⑩熔融NaCl含自由移动的离子,能导电;熔融NaCl是化合物,在熔融状态下能完全电离而导电,属于电解质;
⑪蔗糖为化合物,在熔化或水溶液中均不能电离,不能导电,为非电解质,
故答案为:
| ②⑦⑧⑨⑩ | ①③⑤⑥⑩ | ④⑪ |
故答案为:Ba(OH)2+2HCl═BaCl2+2H2O;
(3)氢氧化铁胶体逐滴加入稀硫酸溶液,先发生聚沉产生氢氧化铁沉淀,然后氢氧化铁与硫酸发生酸碱中和反应生成可溶性硫酸铁和水,所以看的现象为:先产生沉淀后溶解;
故答案为:先产生沉淀后溶解;
(4)氨水中的一水合氨是弱电解质,部分电离产生出自由移动的离子浓度较小,通入HCl后反应生成氯化铵是强电解质,完全电离,所以离子浓度逐渐增大,导电能力逐渐增强,
故答案为:导电能力逐渐增强.
点评 本题考查离子反应方程式及电解质等,为高频考点,把握相关概念及离子反应的书写方法为解答的关键,侧重分析与应用能力的考查,综合性较强,题目难度不大.

| A. | 可以用pH试纸来测定1mol•L-1硫酸溶液的pH | |
| B. | NH3可以使湿润的pH试纸变红 | |
| C. | 用广泛pH试纸测定某氢氧化钠溶液的pH为12.5 | |
| D. | 用干燥洁净的玻璃棒蘸取待测液,滴到pH试纸上,再和标准比色卡对照 |
①混合气体的压强
②混合气体的密度
③混合气体的平均相对分子质量
④各气体的物质的量浓度之比为1:2:1:1.
| A. | ①④ | B. | ①③ | C. | ②④ | D. | ②③ |
| A. | V正减小,V逆增大 | B. | V正增大,V逆减小 | C. | V正V逆都增大 | D. | V正V逆都减小 |
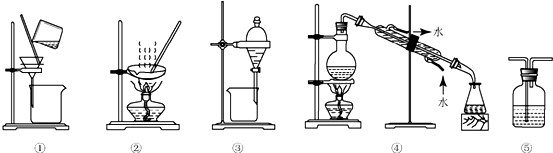
| A. | 分离花生油和NaCl溶液混合液,选④ | B. | 用CC14提取碘水中的碘,选③ | ||
| C. | 用NaOH溶液吸收CO中混有的CO2选⑤ | D. | 粗盐提纯,选①和② |