题目内容
【题目】空气吹出法工艺是目前“海水提溴”的最主要方法之一,其工艺流程如图所示。
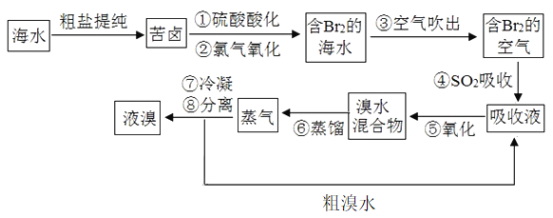
(1)“苦卤”到“含Br2的海水”过程____(填“是”或“不是”)氧化还原反应。
(2)步骤④利用了S02的还原性,反应的离子方程式为____。
(3)步骤⑥的蒸馏过程中,温度应控制在80~90℃。温度过高或过低都不利于生产,其原因是____。
(4)若处理1 m3海水需要消耗0.45 molSO2,不考虑转化过程中溴的损耗,则海水中溴离子的物质的量浓度为____。
【答案】 是 Br2+SO2+2H2O=4H++2Br-+SO42- 温度过高,大量水蒸气随之排出,溴气中水分增加;温度过低,溴不能完全蒸出,产率低 9×10-4mol/L
【解析】
空气吹出法是用于工业规模海水提溴的常用方法,其中一种工艺是在预先经过酸化的浓缩海水中,用氯气置换溴离子使之成为单质溴,继而通入空气和水蒸气,将溴吹入吸收塔,使溴蒸汽和吸收剂二氧化硫发生作用转化成氢溴酸以达到富集的目的,也就是得到富集溴.然后,再用氯气将其氧化得到产品溴,据此解答。
(1)苦卤中含有溴离子,通入氯气把溴离子氧化为单质溴,该过程发生的是氧化还原反应;
(2)SO2具有还原性,和溴水反应生成硫酸和氢溴酸,反应的离子方程式为Br2+SO2+2H2O=4H++2Br-+SO42-;
(3)在溴水中,溴的沸点是58.5℃,水的沸点是100℃,温度过高,大量水蒸气随之排出,溴蒸汽中水蒸气增加;温度过低,溴不能完全蒸出,产率低;
(4)根据方程式Br2+SO2+2H2O=4H++2Br-+SO42-可知1 m3海水中溴离子的物质的量是0.45mol×2=0.9mol,所以海水中溴离子的物质的量浓度为0.9mol÷1000L=9×10-4mol/L。

 互动课堂系列答案
互动课堂系列答案 激活思维智能训练课时导学练系列答案
激活思维智能训练课时导学练系列答案【题目】我国农业生产因遭受酸雨而造成的损失每年高达15亿元。为了有效控制酸雨,目前国务院已批准了《酸雨控制区和二氧化硫污染控制区划分方案》等法规。某实验小组采集硫酸型酸雨样品,随着时间的推移,多次测定该样品的pH,得到了表中数据:(已知pH越小,溶液的酸性越强)
时间(h) | 0 | 8 | 16 | 24 | 32 | 40 | 48 |
pH | 5.0 | 4.8 | 4.5 | 4.3 | 4.2 | 4.0 | 4.0 |
(1)酸雨样品放置时pH变化的主要原因是(用化学方程式表示)____________________。
(2)如果将刚取样的上述酸雨和自来水混合,pH将________(填“增大”“减小”或“不变”),原因是(用化学方程式表示)____________________。
(3)你认为减少酸雨产生可采取的措施是___________(填字母)。
①少用煤作燃料 ②把工厂烟囱造高 ③燃料脱硫 ④在已酸化的土壤中加石灰 ⑤开发新能源
A.①②③ B.②③④⑤ C.①③⑤ D.①③④⑤