题目内容
【题目】晶体硅是一种重要的非金属材料。制备纯硅的主要步骤如下:
①高温下用碳还原二氧化硅制得粗硅;
②粗硅与干燥HCl气体反应制得SiHCl3:Si+3HCl![]() SiHCl3+H2;
SiHCl3+H2;
③SiHCl3与过量H2在1 000~1 100 ℃反应制得纯硅。
已知SiHCl3能与H2O剧烈反应,在空气中易自燃。请回答下列问题:
(1)第①步制备粗硅的化学反应方程式为______________________________。
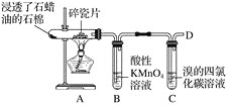
(2)用SiHCl3与过量H2反应制备纯硅的装置如图所示(热源及夹持装置均已略去):

①装置B中的试剂是________。装置C中的烧瓶需要加热,其目的是_________________________。
②反应一段时间后,装置D中观察到的现象是__________________________________,装置D不能采用普通玻璃管的原因是_____________________________,装置D中发生反应的化学方程式为_________________。
③为保证制备纯硅实验的成功,操作的关键是检查实验装置的气密性、控制好反应温度以及______________。
【答案】 SiO2+2C![]() Si+2CO↑ 浓硫酸 使滴入烧瓶中的SiHCl3汽化 有固体物质生成 在反应温度下,普通玻璃会软化 SiHCl3+H2
Si+2CO↑ 浓硫酸 使滴入烧瓶中的SiHCl3汽化 有固体物质生成 在反应温度下,普通玻璃会软化 SiHCl3+H2![]() Si+3HCl 排尽装置中的空气
Si+3HCl 排尽装置中的空气
【解析】
(1)高温下用碳与二氧化硅发生置换反应:SiO2+2C![]() Si+2CO↑;
Si+2CO↑;
(2)①通过锌与稀硫酸反应制备的氢气中混有水蒸气,但SiHCl3能与H2O剧烈反应,在空气中易自燃,应在氢气参加反应前先干燥,所以B中的试剂是浓硫酸; C装置的目的是使SiHCl3和氢气充分混合,进而进入D装置中反应,因此加热C的目的是使SiHCl3汽化;②D中SiHCl3和氢气反应生成固体硅,反应方程式为:SiHCl3+H2![]() Si+3HCl,因为反应加热到1000~1100℃,所以必须用石英管。③由于在高温下硅和氧气可以化合生成二氧化硅,所以必须排尽装置中的空气。
Si+3HCl,因为反应加热到1000~1100℃,所以必须用石英管。③由于在高温下硅和氧气可以化合生成二氧化硅,所以必须排尽装置中的空气。

 云南师大附小一线名师提优作业系列答案
云南师大附小一线名师提优作业系列答案 冲刺100分单元优化练考卷系列答案
冲刺100分单元优化练考卷系列答案