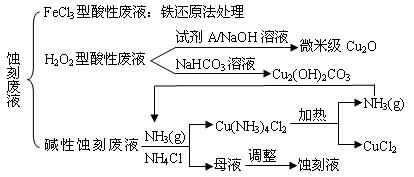
题目内容
(16分)以硫铁矿(主要成分为FeS2)为原料制备氯化铁晶体(FeCl3·6H2O)的工艺流程如下:
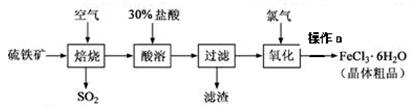
回答下列问题:
(1)在一定条件下,SO2转化为SO3的反应为2SO2+O2 2SO3,该反应的平衡常数表达式为K= ;过量的SO2与NaOH溶液反应的化学方程式为 。
2SO3,该反应的平衡常数表达式为K= ;过量的SO2与NaOH溶液反应的化学方程式为 。
(2)用36.5%(密度为1.2g·㎝-3)的盐酸的配制500mL的30%(密度为1.095g·㎝-3的盐酸,所需玻璃仪器是 ( )
E、500mL容量瓶 F、胶头滴管
(3)酸溶及后续过程中均需保持盐酸过量,其目的是 、
。
(4)通氯气氧化时,发生的主要反应的离子方程式为 ;该过程产生的尾气可用碱 溶液吸收,尾气中污染空气的气体为 (写化学式)。
溶液吸收,尾气中污染空气的气体为 (写化学式)。
(5)操作a为 、过滤、洗涤、干燥。

回答下列问题:
(1)在一定条件下,SO2转化为SO3的反应为2SO2+O2
 2SO3,该反应的平衡常数表达式为K= ;过量的SO2与NaOH溶液反应的化学方程式为 。
2SO3,该反应的平衡常数表达式为K= ;过量的SO2与NaOH溶液反应的化学方程式为 。(2)用36.5%(密度为1.2g·㎝-3)的盐酸的配制500mL的30%(密度为1.095g·㎝-3的盐酸,所需玻璃仪器是 ( )
| A.玻璃棒 | B.烧杯 | C.托盘天平 | D.500mL量筒 |
(3)酸溶及后续过程中均需保持盐酸过量,其目的是 、
。
(4)通氯气氧化时,发生的主要反应的离子方程式为 ;该过程产生的尾气可用碱
 溶液吸收,尾气中污染空气的气体为 (写化学式)。
溶液吸收,尾气中污染空气的气体为 (写化学式)。(5)操作a为 、过滤、洗涤、干燥。
(1)k=c2(SO3)/c(O2)·c2(SO2) (3分) SO2+NaOH=NaHSO3(2分)
(2) AB D EF(3分,每答错1个或少选1个扣1分)
(3)提高铁元素的浸出率(1分) 抑制Fe3+水解(1分)
(4)Cl2+2Fe2+=2Cl-+2Fe3+(2分) Cl2 HCl(2分)
(5)蒸发浓缩、冷却结晶(2分)
(2) AB D EF(3分,每答错1个或少选1个扣1分)
(3)提高铁元素的浸出率(1分) 抑制Fe3+水解(1分)
(4)Cl2+2Fe2+=2Cl-+2Fe3+(2分) Cl2 HCl(2分)
(5)蒸发浓缩、冷却结晶(2分)
略

练习册系列答案
相关题目
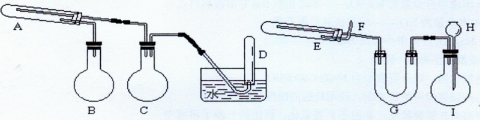
 种光敏材料,在110℃可完全失去结晶水。为测定该晶体中铁的含量和结晶水的含量,某实验小组做了如下实验:
种光敏材料,在110℃可完全失去结晶水。为测定该晶体中铁的含量和结晶水的含量,某实验小组做了如下实验: 质量;计算结晶水含量。请纠正实验过程中的两处错误;___▲_____;_____▲____。
质量;计算结晶水含量。请纠正实验过程中的两处错误;___▲_____;_____▲____。