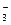题目内容
将mg Al2O3、Fe2O3的混和物溶解在过量的100mLpH值为1的硫酸中,然后向其中加入NaOH溶液使Fe3+、Al3+刚好全部转化成沉淀,用去NaOH溶液100mL,则NaOH溶液的浓度为
| A.0.1mol/L | B.0.05mol/L | C.0.2mol/L | D.无法计算 |
A
依题意,混合物发生反应前后,反应物和生成物的关系如下:Al2O3+Fe2O3+H2SO4+NaOH
 Al(OH)3+Fe(OH)3+Na2SO4,易知最终溶液中NaOH全部转化为Na2SO4,根据H2SO4的量可以推算出NaOH的量来。n(H2SO4)=
Al(OH)3+Fe(OH)3+Na2SO4,易知最终溶液中NaOH全部转化为Na2SO4,根据H2SO4的量可以推算出NaOH的量来。n(H2SO4)=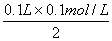 ="0.005" mol,则n(NaOH)=2n(H2SO4)="0.01" mol,c(NaOH)=
="0.005" mol,则n(NaOH)=2n(H2SO4)="0.01" mol,c(NaOH)=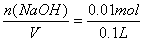 ="=0.1" mol/L。本题选A。B选项为本题的干扰选项,若没有注意到硫酸溶液的pH值与硫酸溶液浓度的关系,就容易误选B。
="=0.1" mol/L。本题选A。B选项为本题的干扰选项,若没有注意到硫酸溶液的pH值与硫酸溶液浓度的关系,就容易误选B。
练习册系列答案
 寒假学与练系列答案
寒假学与练系列答案
相关题目
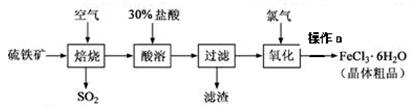
 2SO3,该反应的平衡常数表达式为K= ;过量的SO2与NaOH溶液反应的化学方程式为 。
2SO3,该反应的平衡常数表达式为K= ;过量的SO2与NaOH溶液反应的化学方程式为 。 溶液吸收,尾气中污染空气的气体为 (写化学式)。
溶液吸收,尾气中污染空气的气体为 (写化学式)。
 直接反应制得,请配平下列反应的离子方程式: Cu2+ + I
直接反应制得,请配平下列反应的离子方程式: Cu2+ + I