题目内容
往100 mL FeCl3溶液中,通入0.672L标准状况下的硫化氢气体,设气体完全被吸收,再加入过量的铁粉,反应停止后,测得溶液中含有0.12mol金属阳离子,则原氯化铁溶液的物质的量浓度为
| A.0.1 mo/L | B.1 mo/L | C.0.08 mo/L | D.0.8 mo/L |
D
0.672L标准状况下的硫化氢气体的物质的量为0.03mol,与FeCl3溶液反应的方程式为: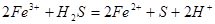 ,0.03mol硫化氢气体要消耗,0.06molFeCl3,生成FeCl20.06mol,及0.06molH+;再加入过量的铁粉其反应为
,0.03mol硫化氢气体要消耗,0.06molFeCl3,生成FeCl20.06mol,及0.06molH+;再加入过量的铁粉其反应为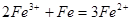 ,
,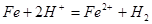 ;反应停止后,测得溶液中含有0.12mol金属阳离子,所以,有0.06mol FeCl2由
;反应停止后,测得溶液中含有0.12mol金属阳离子,所以,有0.06mol FeCl2由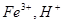 与铁反应而成,而H+的物质的量为0.06mol,与铁反应生成
与铁反应而成,而H+的物质的量为0.06mol,与铁反应生成 物质的量为0.03 mol,即还有0.03 mol
物质的量为0.03 mol,即还有0.03 mol 由
由 与铁反应生成,即
与铁反应生成,即 需0.02 mol;所以100 mL FeCl3溶液中FeCl3的物质的量为
需0.02 mol;所以100 mL FeCl3溶液中FeCl3的物质的量为 ,即其物质的量浓度为0.8 mo/L;
,即其物质的量浓度为0.8 mo/L;
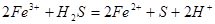 ,0.03mol硫化氢气体要消耗,0.06molFeCl3,生成FeCl20.06mol,及0.06molH+;再加入过量的铁粉其反应为
,0.03mol硫化氢气体要消耗,0.06molFeCl3,生成FeCl20.06mol,及0.06molH+;再加入过量的铁粉其反应为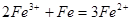 ,
,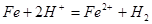 ;反应停止后,测得溶液中含有0.12mol金属阳离子,所以,有0.06mol FeCl2由
;反应停止后,测得溶液中含有0.12mol金属阳离子,所以,有0.06mol FeCl2由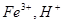 与铁反应而成,而H+的物质的量为0.06mol,与铁反应生成
与铁反应而成,而H+的物质的量为0.06mol,与铁反应生成 物质的量为0.03 mol,即还有0.03 mol
物质的量为0.03 mol,即还有0.03 mol 由
由 与铁反应生成,即
与铁反应生成,即 需0.02 mol;所以100 mL FeCl3溶液中FeCl3的物质的量为
需0.02 mol;所以100 mL FeCl3溶液中FeCl3的物质的量为 ,即其物质的量浓度为0.8 mo/L;
,即其物质的量浓度为0.8 mo/L;
练习册系列答案
相关题目
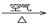 CuO
CuO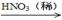 Cu(NO3)2
Cu(NO3)2 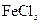 可用作印刷电路铜板腐蚀剂。
可用作印刷电路铜板腐蚀剂。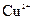 、
、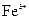 的浓度均为
的浓度均为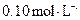 ,不考虑溶液体积的变化,则原
,不考虑溶液体积的变化,则原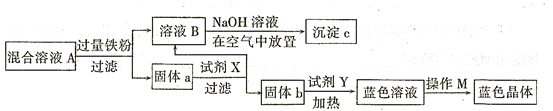
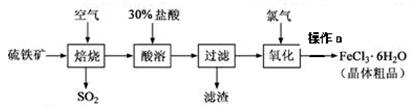
 2SO3,该反应的平衡常数表达式为K= ;过量的SO2与NaOH溶液反应的化学方程式为 。
2SO3,该反应的平衡常数表达式为K= ;过量的SO2与NaOH溶液反应的化学方程式为 。 溶液吸收,尾气中污染空气的气体为 (写化学式)。
溶液吸收,尾气中污染空气的气体为 (写化学式)。 a2Fe2O4+ NH3+ NaOH
a2Fe2O4+ NH3+ NaOH Fe3O4+4NaOH
Fe3O4+4NaOH 。若有1mol Na2Fe2O4生成,则反应中有____________mol电子转移。
。若有1mol Na2Fe2O4生成,则反应中有____________mol电子转移。 4g胆矾溶于水配成1000 mL溶液
4g胆矾溶于水配成1000 mL溶液