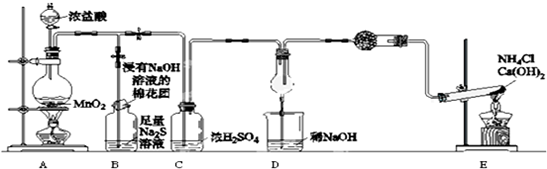
题目内容
20.设阿伏加德罗常数的值为NA,则下列说法不正确的是( )| A. | 1mol Na参加氧化还原反应时电子转移NA | |
| B. | 3.2g SO2与2.3g NO2所含有的氧原子数相等 | |
| C. | 标准状况下,2.24L H2O含有的O原子数为0.1NA | |
| D. | 1L 0.1mol/LMgCl2溶液中Cl-离子数为0.2NA |
分析 A、反应后钠变为+1价;
B、求出SO2和NO2的物质的量,然后根据两者中均含2个氧原子来计算;
C、标况下,水为液态;
D、求出氯化镁的物质的量n=CV,然后根据1mol氯化镁中含2mol氯离子来分析.
解答 解:A、反应后钠变为+1价,故1mol钠参与反应后转移1mol电子即NA个,故A正确;
B、3.2SO2的分子个数N=$\frac{3.2g}{64g/mol}$NA=0.05NA,2.3gNO2的分子个数=$\frac{2.3g}{46g/mol}{N}_{A}$=0.05NA,一个二氧化硫分子或二氧化氮分子中都含有2个氧原子,所以含有氧原子的个数相等,故B正确;
C、标况下,水为液态,不能根据气体摩尔体积来计算其物质的量,故C错误;
D、1L0.1mol/LMgCl2溶液中氯化镁的物质的量是0.1mol,一个氯化镁的化学式中含有2个氯离子,所以氯离子的个数为0.2NA个,故D正确.
故选C.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.

练习册系列答案
相关题目
11.某化学研究性学习小组通过查阅资料,设计了如下图所示的方法以含镍废催化剂为原料来制备NiSO4•7H2O.已知某化工厂的含镍催化剂主要含有Ni,还含有Al(31%)、Fe(1.3%)的单质及氧化物,其他不溶杂质(3.3%).
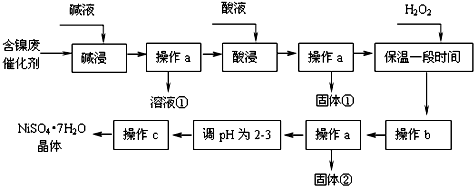
部分阳离子以氢氧化物形式开始沉淀和完全沉淀时的pH如下:
回答下列问题:
(1)操作a、c中需使用的仪器除铁架台(带铁圈)、酒精灯、烧杯、玻璃棒外还需要的主要仪器为漏斗、蒸发皿.
(2)“碱浸”过程中发生的离子方程式是2Al+2OH-+2H2O═2AlO2-+3H2↑、Al2O3+2OH-═2AlO2-+3H2O
(3)“酸浸”时所加入的酸是H2SO4(填化学式).酸浸后,经操作a分离出固体①后,溶液中可能含有的金属离子是Ni2+、Fe2+.
(4)操作b为调节溶液的pH,你认为pH的最佳调控范围是:3.2-7.2.
(5)“调pH为2~3”的目的是防止在浓缩结晶过程中Ni2+水解
(6)操作c的方法是:蒸发浓缩、冷却结晶、过滤
(7)产品晶体中有时会混有少量绿矾(FeSO4•7H2O),其原因可能是H2O2的用量不足(或H2O2失效)、保温时间不足导致Fe2+未被完全氧化造成的.

部分阳离子以氢氧化物形式开始沉淀和完全沉淀时的pH如下:
| 沉淀物 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 | Ni(OH)2 |
| 开始沉淀pH | 3.4 | 1.8 | 7.5 | 7.2 |
| 完全沉淀pH | 5.2 | 3.2 | 9.7 | 9.2 |
(1)操作a、c中需使用的仪器除铁架台(带铁圈)、酒精灯、烧杯、玻璃棒外还需要的主要仪器为漏斗、蒸发皿.
(2)“碱浸”过程中发生的离子方程式是2Al+2OH-+2H2O═2AlO2-+3H2↑、Al2O3+2OH-═2AlO2-+3H2O
(3)“酸浸”时所加入的酸是H2SO4(填化学式).酸浸后,经操作a分离出固体①后,溶液中可能含有的金属离子是Ni2+、Fe2+.
(4)操作b为调节溶液的pH,你认为pH的最佳调控范围是:3.2-7.2.
(5)“调pH为2~3”的目的是防止在浓缩结晶过程中Ni2+水解
(6)操作c的方法是:蒸发浓缩、冷却结晶、过滤
(7)产品晶体中有时会混有少量绿矾(FeSO4•7H2O),其原因可能是H2O2的用量不足(或H2O2失效)、保温时间不足导致Fe2+未被完全氧化造成的.
5.下列无色溶液离子中,能共存的是( )
| A. | Fe3+、Cl-、Na+ | B. | Ba2+、Mg2+、CO32- | C. | Na+、K+、CO32- | D. | NO3-、Al3+、OH- |
9.当光束通过下列分散系:①有尘埃的空气 ②氯化铁稀溶液 ③稀豆浆 ④墨水;能观察到丁达尔现象的有( )
| A. | ①② | B. | ③④ | C. | ①③④ | D. | ①②③④ |
15.原子序数依次增大的四种短周期元素X,Y,Z,M.其中Z是金属元素,X的原子半径小于Y,Y与M同主族,Y的质子数为M的$\frac{1}{2}$,下列说法一定正确的是( )
| A. | X与M的原子序数之差为31 | |
| B. | Y的离子半径小于Z的离子半径 | |
| C. | 由X与Z组成的化合物,可与水反应放出X2 | |
| D. | 由M与Y组成的化合物,其水化物是强酸 |
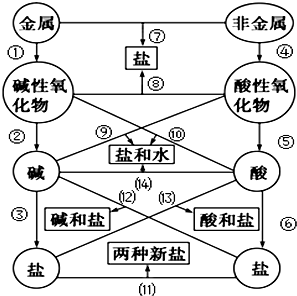 图中的“金属”为Na,“非金属”为S.仔细阅读两种元素在图示中经历的反应变化,回答下列问题.
图中的“金属”为Na,“非金属”为S.仔细阅读两种元素在图示中经历的反应变化,回答下列问题.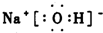 .
.