题目内容
10.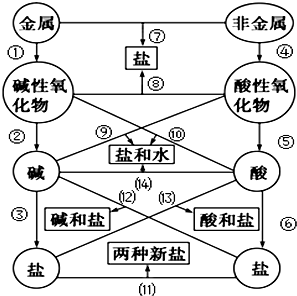 图中的“金属”为Na,“非金属”为S.仔细阅读两种元素在图示中经历的反应变化,回答下列问题.
图中的“金属”为Na,“非金属”为S.仔细阅读两种元素在图示中经历的反应变化,回答下列问题.(1)反应①中的反应类型是化合反应.
(2)反应②中“碱”的电子式是
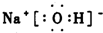 .
.(3)反应③产生的盐为NaHCO3,则该化学反应的离子方程式是CO2+OH-=HCO3-.
(4)反应④的“酸性氧化物”能在大气中被氧化形成酸雨,用化学方程式表示其形成酸雨的过程:SO2+H2O?H2SO3、2H2SO3+O2═2H2SO4,或2SO2+O2$\stackrel{粉尘}{?}$2SO3、SO3+H2O═H2SO4
(5)反应⑤为非氧化还原反应,该“酸”属于BC.
A 强电解质 B 弱电解质 C 二元酸 D 离子化合物
(6)反应⑥产生的盐,能发生反应(12).写出一种该盐的化学式Na2SO3.
(7)反应(14)中若“酸”、“碱”未完全中和,产生的盐是NaHSO3.
分析 图中的“金属”为Na,“非金属”为S.①可为Na和氧气反应生成碱性氧化物氧化钠,②可为氧化钠和水反应生成氢氧化钠,③可为氢氧化钠和过量二氧化碳反应生成碳酸氢钠或过量氢氧化钠和少量二氧化碳反应生成碳酸钠和水,④可为硫和氧气反应生成二氧化硫,⑤可为二氧化硫和水反应生成亚硫酸,⑥可为亚硫酸和氢氧化钠反应生成亚硫酸氢钠,⑦硫和钠反应生成硫化钠,⑧氧化钠和二氧化硫反应生成亚硫酸钠,⑨可为二氧化硫和氢氧化钠反应生成亚硫酸钠和水,(10)为氧化钠和亚硫酸反应生成亚硫酸钠和水,(11)可为碳酸钠和亚硫酸氢钠反应生成碳酸氢钠和亚硫酸钠,(12)可为亚硫酸氢钠和氢氧化钠反应生成亚硫酸钠和水,(13)为亚硫酸和碳酸氢钠反应生成碳酸(分解生成二样氧化碳和水)和亚硫酸钠,(14)亚硫酸和氢氧化钠反应生成亚硫酸钠和水.
解答 解:(1)反应①为金属钠反应生成碱性氧化物,可为Na和氧气反应生成碱性氧化物氧化钠,反应类型为化合反应,
故答案为:化合反应;
(2)图中的“金属”为Na,所以反应②中“碱”指氢氧化钠,氢氧化钠为离子化合物,钠离子与氢氧根离子通过离子键结合而成,NaOH的电子式: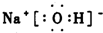 ,
,
故答案为: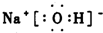 ;
;
(3)反应③产生的盐为NaHCO3,可为氢氧化钠和过量二氧化碳反应生成碳酸氢钠,则该化学反应的离子方程式是:CO2+OH-=HCO3-,
故答案为:CO2+OH-=HCO3-;
(4)二氧化硫和水反应生成亚硫酸,亚硫酸能和氧气反应生成硫酸,反应的化学方程式分别为:SO2+H2O?H2SO3、2H2SO3+O2═2H2SO4,或二氧化硫与氧气在空气中粉尘的催化下生成三氧化硫,三氧化硫与水化合生成硫酸,反应的化学方程式分别为:2SO2+O2$\stackrel{粉尘}{?}$2SO3、SO3+H2O═H2SO4,
故答案为:SO2+H2O?H2SO3、2H2SO3+O2═2H2SO4,或2SO2+O2$\stackrel{粉尘}{?}$2SO3、SO3+H2O═H2SO4;
(5)反应⑤为非氧化还原反应,可为二氧化硫和水反应生成亚硫酸,亚硫酸分步电离,以第一步电离为主,电离方程式为:H2SO3?H++HSO3-,HSO3-?H++SO32-,“H2SO3”属于弱电解质,二元酸,共价化合物,
故答案为:BC;
(6)⑥可为亚硫酸和氢氧化钠反应生成亚硫酸氢钠,反应⑥产生的盐为亚硫酸氢钠,(12)可为亚硫酸氢钠和氢氧化钠反应生成亚硫酸钠和水,所以盐为亚硫酸钠,化学式为:Na2SO3,
故答案为:Na2SO3;
(7)反应(14)中若“酸”、“碱”未完全中和,亚硫酸和氢氧化钠反应生成亚硫酸氢钠和水,产生的盐是NaHSO3,
故答案为:NaHSO3;
点评 本题考查了元素化合物的推断,掌握钠、硫及其化合物的性质是解答的关键,题目难度中等.

①能使酸性KMnO4溶液褪色;
②可发生加成反应;
③可溶于水;
④可溶于苯中;
⑤能与浓硝酸在浓H2SO4作用下发生取代反应;
⑥所有的原子可能共平面.
| A. | ①②③④⑤ | B. | ①②⑤⑥ | C. | ①②④⑤⑥ | D. | 全部 |
| A. | 滤液中一定含有Al3+、Ag+ | B. | 滤液中一定含有Fe2+、Ag+ | ||
| C. | 滤渣中一定含有Fe | D. | 滤渣中一定含有Ag |
| A. | 由不同种类的原子构成的物质不可能是单质 | |
| B. | 葡萄糖注射液不能产生丁达尔现象,不属于胶体 | |
| C. | 蔗糖、硫酸钡和氨气分别属于非电解质、强电解质和弱电解质 | |
| D. | 硫酸、纯碱、醋酸钠和生石灰分别属于酸、碱、盐和氧化物 |
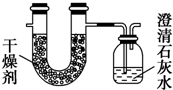 用以下几种常见有机物填写下列空白:
用以下几种常见有机物填写下列空白:a.CH4 b.C2H4 c.C6H6 d.C2H5OH e.CH3COOH
(1)等质量的CH4、C2H4、C6H6三种烃完全燃烧消耗O2的量由多到少的顺序是a>b>c(用序号表示).
(2)等物质的量混合的甲烷和乙酸蒸气完全燃烧所得二氧化碳和水蒸气的物质的量之比为3:4.
(3)由乙烯和乙醇蒸气组成的混合气体1mol完全燃烧所需氧气在标准状况下的体积为67.2L.
(4)由两种气态烃组成的混合气体完全燃烧后,将产生的气体全部通过图示装置,得到如表所列的实验数据(产生的气体完全被吸收).
| 实验前 | 实验后 | |
| (干燥剂+U形管)的质量 | 101.1g | 104.7g |
| (澄清石灰水+广口瓶)的质量 | 312.0g | 318.6g |
①假设广口瓶里生成一种正盐,其质量为15g.
②混合气体中C、H两元素的物质的量之比为3:8.
③若混合气体是由CH4和C2H4组成,则二者的体积比为1:1.
| A. | 3molH2 | B. | 98gH2SO4 | C. | 标况下11.2LC2H6 | D. | 3.01×1023个HCl |
| A. | Na2CO3溶液 | B. | CaCO3 | C. | NaHCO3溶液 | D. | Na2SO4溶液 |
| A. | 1mol Na参加氧化还原反应时电子转移NA | |
| B. | 3.2g SO2与2.3g NO2所含有的氧原子数相等 | |
| C. | 标准状况下,2.24L H2O含有的O原子数为0.1NA | |
| D. | 1L 0.1mol/LMgCl2溶液中Cl-离子数为0.2NA |