题目内容
12.某校学生化学实验小组,为验证非金属元素氯的氧化性强于硫和氮,设计了一套实验装置:(部分夹持装置已略去)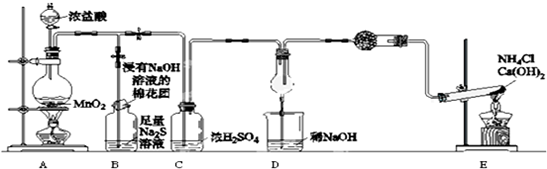
(1)写出A中反应的离子方程式MnO2+4H++2Cl$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O.
(2)B中出现黄色浑浊现象,产生此现象的离子方程式Cl2+S2-=S↓+2Cl-.
(3)浸有NaOH溶液的棉花团的作用是吸收多余的氯气.
(4)D中干燥管中出现的明显现象及化学方程式是产生大量白烟;8NH3+3Cl2=6NH4Cl+N2.
(5)有同学认为D中的现象并不能说明氯的氧化性大于氮,需要在C之前加装洗气装置,该洗气装置中盛装氯化钠试剂.
(6)还有什么方法能证明氧化性Cl2>S,(用化学方程式表示)2Fe+3Cl2$\frac{\underline{\;\;△\;\;}}{\;}$2FeCl3、Fe+S$\frac{\underline{\;\;△\;\;}}{\;}$FeS.
分析 非金属性强弱比较的一般规律是:①根据氧化还原反应判断:同一化学反应,氧化剂的氧化性强于氧化产物的氧化性;②由对应氢化物的稳定性判断:氢化物越稳定,非金属性越强.③由最高价氧化物对应水化物的酸性来判断:酸性越强,非金属越强.(除氟元素之外).④非金属单质与具有可变价金属的反应.能生成高价金属化合物的,其非金属性强,据此可以验证.
为验证非金属元素氯的氧化性强于硫,该实验通过氯气把硫化钠溶液中的硫离子氧化为S单质说明,为验证非金属元素氯的氧化性强于氮,通过氯气能把氨气氧化生成氮气和氯化氢说明,实验装置中,A制取氯气:MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O,浓盐酸易挥发,经过浓硫酸干燥的氯气中扔混有少量氯化氢气体,因此需要在C加一吸收装置除掉氯化氢,需要在C之前加装洗气装置,为该实验装置设计缺陷,B装置为为验证非金属元素氯的氧化性强于硫,B中出现黄色浑浊现象,说明有S沉淀生成,氯气的氧化性大于S的氧化性,反应为:Cl2+S2-=S↓+2Cl-,装置C进行干燥氯气,盛放氢氧化钠的烧杯吸收尾气,装置E为:氯化铵和氢氧化钙固体加热反应生成氨气,反应的化学方程式为2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$2NH3↑+2H2O+CaCl2;装置D氯气能把氨气氧化生成氮气和氯化氢,生成的氯化氢和氨气结合生成氯化铵,从而冒白烟,验证非金属元素氯的氧化性强于氮.
(1)此反应装置为浓盐酸和二氧化锰共热制备氯气,以此写出化学方程式;
(2)B中出现黄色浑浊现象,说明有S沉淀生成,氯气的氧化性大于S的氧化性;
(3)氯气污染环境,浸有NaOH溶液的棉花团可以吸收多余的氯气;
(4)装置E为实验室制取氨气的装置,氯气能把氨气氧化生成氮气和氯化氢,氯化氢与氨气反应生成氯化铵,故现象为冒白烟;
(5)浓盐酸易挥发,经过浓硫酸干燥的氯气中仍混有少量氯化氢气体,因此需要在C加一吸收装置除掉氯化氢;
(6)依据非金属性强弱比较的一般规律进行验证.
解答 解:(1)反应装置A为浓盐酸和二氧化锰共热制备氯气的装置,其离子方程式为:MnO2+4H++2Cl$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O,
故答案为:MnO2+4H++2Cl$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O;
(2)反应制备的氯气通入B之后,B中出现黄色浑浊现象,说明氯气把硫化钠溶液中的硫离子氧化为S单质,离子方程式为Cl2+S2-=S↓+2Cl-,
故答案为:Cl2+S2-=S↓+2Cl-;
(3)氯气污染环境,浸有NaOH溶液的棉花团可以吸收多余的氯气,反应为:Cl2+2NaOH═NaCl+NaClO+H2O,
故答案为:吸收多余的氯气;
(4)通E装置是制备氨气,氯气能把氨气氧化生成氮气和氯化氢,生成的氯化氢和氨气结合生成氯化铵,从而冒白烟,因此实验的现象是产生大量白烟,反应的方程式是8NH3+3Cl2=6NH4Cl+N2,
故答案为:产生大量白烟;8NH3+3Cl2=6NH4Cl+N2;
(5)盐酸易挥发,所以生成氯气中含有氯化氢气体,氯化氢也能直接和氨气结合冒白烟,所以需要在C之前连接一盛有饱和食盐水的装置以除去氯化氢气体,装置图为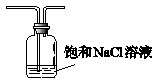 ,
,
故答案为:氯化钠;
(6)非金属性强弱比较的一般规律是:①由对应氢化物的稳定性判断:氢化物越稳定,非金属性越强.②由最高价氧化物对应水化物的酸性来判断:酸性越强,非金属越强.(除氟元素之外).③非金属单质与具有可变价金属的反应.能生成高价金属化合物的,其非金属性强,据此可以验证,所以还可用以下方法能证明氧化性Cl2>S,方法一:2Fe+3Cl2$\frac{\underline{\;\;△\;\;}}{\;}$2FeCl3、Fe+S$\frac{\underline{\;\;△\;\;}}{\;}$FeS;方法二:相同温度下相同状态的HCl的稳定性大于H2S;方法三:最高价氧化物对应的水化物的酸性HClO4 大于H2SO4.用化学方程式表示选择方法一,
故答案为:2Fe+3Cl2$\frac{\underline{\;\;△\;\;}}{\;}$2FeCl3、Fe+S$\frac{\underline{\;\;△\;\;}}{\;}$FeS.
点评 本题考查实验方案的设计与评价,考查了氯气、氨气的实验室制法及性质的检验,明确制备原理及物质的性质是解题关键,题目难度中等.

 一课一练课时达标系列答案
一课一练课时达标系列答案| A. | 3molH2 | B. | 98gH2SO4 | C. | 标况下11.2LC2H6 | D. | 3.01×1023个HCl |
| 实验目的 | 实验方案 | |
| A | 检验碳与浓硫酸反应后的气体产物 | 将产生的气体依次通过无水CuSO4、澄清石灰水和品红溶液 |
| B | 证明蛋白质在某些无机盐溶液作用下发生变性 | 向鸡蛋清溶液中加入饱和硫酸钠溶液,有沉淀析出;再把沉淀加入蒸馏水中 |
| C | 检验蔗糖水解产物具有还原性 | 向蔗糖溶液中加入几滴稀硫酸,水浴加热几分钟,然后加入适量稀NaOH溶液,再向其中加入新制的银氨溶液,并水浴加热 |
| D | 证明非金属性S>C | 测定等物质的量浓度的Na2SO3与Na2CO3溶液的pH,后者较大 |
| A. | A | B. | B | C. | C | D. | D |
| A. | 1mol Na参加氧化还原反应时电子转移NA | |
| B. | 3.2g SO2与2.3g NO2所含有的氧原子数相等 | |
| C. | 标准状况下,2.24L H2O含有的O原子数为0.1NA | |
| D. | 1L 0.1mol/LMgCl2溶液中Cl-离子数为0.2NA |
| A. | As的最高正价为+3价 | B. | AsH3的稳定性比PH3强 | ||
| C. | 氧化物的水化物酸性:As<N | D. | As是第4周期第VA族元素 |
(1)SO2+I2+2H2O═H2SO4+2HI
(2)2H2SO4═2SO2+O2+2H2O
(3)2HI═H2+I2
下列说法正确的是( )
| A. | 反应(1)中SO2氧化性比HI强 | |
| B. | 循环过程中不需要补充H2O | |
| C. | 循环过程H2O作催化剂 | |
| D. | 循环过程中产生1mol H2的同时产生0.5mol O2 |

| A. | 在一定条件下能与溴发生取代反应 | |
| B. | 能被高锰酸钾酸性溶液氧化 | |
| C. | 在加热和催化剂作用下,能与氢气反应 | |
| D. | 所有碳原子不可能共面且不能与氢溴酸发生加成反应 |
 乙酸正丁酯是一种重要化工原料,某实验小组利用图1、图2装置合成乙酸正丁酯(夹持装置已略去),发生的化学反应为:
乙酸正丁酯是一种重要化工原料,某实验小组利用图1、图2装置合成乙酸正丁酯(夹持装置已略去),发生的化学反应为:CH3COOH+CH3CH2CH2CH2OH$?_{△}^{浓硫酸}$CH3COOCH2CH2CH2CH3+H2O
可能用到的有关数据见下表:
| 相对分子质量 | 沸点/℃ | 密度(g/cm3) | 水中溶解度 | |
| 正丁醇 | 74 | 117.2 | 0.80 | 微溶 |
| 乙酸 | 60 | 118.1 | 1.05 | 易溶 |
| 乙酸正丁酯 | 116 | 126.5 | 0.90 | 微溶 |
①在圈1的圆底烧瓶中,装入7.Og正丁醇和7.Og冰醋酸,再加入3-4滴浓硫酸.
②如图1所示,安装分水器和回流冷凝管.加热圆底烧瓶,待反应基本完成后,停止加誊
③冷却后将分水器中分出的酯层和圆底烧瓶中的反应液一起倒入分液漏斗中.先后用水、10%碳酸钠溶液洗涤.分离得到的酯层再用水洗涤后倒入锥形瓶中,加无水硫酸镁干燥.
④将干燥后的酯层倒入图2的蒸馏烧瓶中,加热蒸馏.收集124℃-126℃的馏分,称得质量为7.0g.
回答下列问题:
(1)图2冷凝管中冷水从b口流入(用字母表示);仪器d的名称是尾接管.
(2)分液漏斗使用前须检漏并洗净备用.分离上下层液体时,应先打开分液漏斗上端的玻璃塞,然后打开活塞放出下层液体,上层液体从上口倒出.
(3)实验中产生的副产物的结构简式为CH3CH2CH=CH2(任写一种).用10%碳酸钠溶液洗涤的主要目的是除去产品中含有的乙酸、硫酸等杂质.
(4)实验中国1圆底烧瓶c的容积最适合的是B(选填字母).
A.25mL B.50mL C.250mL D.500mL
(5)分水器中预先加水至略低于支管口.在加热过程中,除去生成水的操作是打开分水器下端的活塞,让水流出:判断
反应基本完成的标志是分水器中水面高度基本不再变化.
(6)实验中,乙酸正丁酯的产率为63.8%.
| A. | ①②③中的氧化产物分别是I2、Fe3+、CoCl2 | |
| B. | 根据以上方程式可以得到氧化性Cl2>Fe3+>Co2O3 | |
| C. | 在③反应中当1molCo2O3参加反应时,2molHCl被氧化 | |
| D. | 可以推理得到Cl2+FeBr2═FeCl2+Br2 |