题目内容
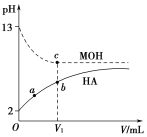
【题目】某混合物X由Al2O3、Fe2O3、Cu、SiO2中的一种或几种物质组成。现进行如下图所示实验。下列有关说法正确的是

A. 步骤Ⅰ中减少的3 g固体一定是混合物
B. 步骤Ⅱ中质量减少的固体物质一定是Fe2O3
C. 根据上述步骤Ⅱ可以得出蓝色溶液中n(Cu2+)=0.02 mol
D. 根据步骤Ⅰ、Ⅱ可以判断X中氧化铁的质量分数为50%
【答案】C
【解析】
A.Al2O3、SiO2都能够与NaOH溶液反应,所以步骤I中减少的3g固体可能为氧化铝或二氧化硅,不一定为混合物,故A错误;
B.步骤II中发生了反应:Fe2O3+6H+═2Fe3++3H2O、Cu+2Fe3+═2Fe2++Cu2+,6.4g固体为铜和Fe2O3的混合物,减少的为铜和氧化铁,故B错误;
C.6.4g变成1.92g,质量减少:6.4g-1.92g=4.48g,减少的质量为Fe2O3和部分Cu,剩余的1.92g为铜,设铜的物质的量为x,根据反应Cu+2Fe3+═2Fe2++Cu2+可知氧化铁的物质的量也为x,则64x+160x=4.48,解得x=0.02mol,则反应后蓝色溶液中含有0.02mol铜离子,故C正确;
D.160g/mol×0.02mol=3.2g,X中氧化铁的质量分数为:![]() ×100%=34.0%,故D错误;
×100%=34.0%,故D错误;

【题目】下列实验方案能达到实验目的的是
选项 | 实验目的 | 实验方案 |
A | 比较Ksp(BaCO3)<Ksp(BaSO4) | 向BaSO4悬浊液中加入饱和Na2CO3溶液,充分搅拌,静置,过滤,洗涤。向滤渣中加入盐酸有气泡产生 |
B | 比较CH3COOH和HClO的酸性强弱 | 用pH试纸分别测量物质的量浓度相等的CH3COONa和NaClO溶液的pH |
C | 配制480 mL 0.2 mol·L1 CuSO4溶液 | 将25 g CuSO4·5H2O溶于蒸馏水配成500 mL溶液 |
D | 验证Na2SO3是否变质 | 在Na2SO3溶液中滴入Ba(NO3)2溶液产生白色沉淀,滴入盐酸沉淀不溶解 |
A. A B. B C. C D. D