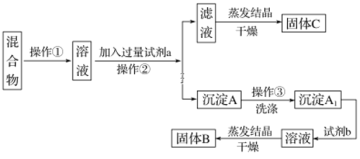
ƒøƒ⁄»ð
°æƒø°ø»Á±Ì «a°´p Æ“ª÷÷‘™Àÿ‘⁄÷Ð∆⁄±Ì÷–µƒŒª÷√£¨«Îªÿ¥œ¬¡–Œ £∫
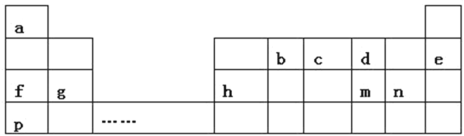
£®1£©mµƒ“ı¿Î◊”Ω·ππ æ“‚ÕºŒ™________
£®2£©d‘™Àÿ‘⁄÷Ð∆⁄±Ì÷–µƒŒª÷√Œ™________
£®3£©bµƒ◊Ó∏þº€—ıªØŒÔµƒΩ·ππ ΩŒ™________
£®4£©d°¢g°¢n–Œ≥…µƒºÚµ•¿Î◊”µƒ∞Îæ∂”…¥ÛµΩ–°µƒÀ≥–ÚŒ™________£®”√¿Î◊”∑˚∫≈ÃÓ–¥£©°£
£®5£©f°¢g°¢pµƒ◊Ó∏þº€—ıªØŒÔµƒÀƪ،ԺӖ‘¥”«øµΩ»ıµƒÀ≥–ÚŒ™________£®ÃÓªØ—ß Ω£©°£
£®6£©p∫Õn¡Ω÷÷‘™Àÿ◊Ó∏þº€—ıªØŒÔµƒÀƪ،Ԝýª•∑¥”¶µƒªØ—ß∑¥”¶∑Ω≥Ã ΩŒ™________
£®7£©cµƒ«‚ªØŒÔ∫Õcµƒ◊Ó∏þº€—ıªØŒÔ∂‘”¶Àƪ،Ô÷ƺ‰∑¥”¶µƒªØ—ß∑Ω≥Ã ΩŒ™________
£®8£©“‘…œ‘™Àÿ◊È≥…µƒŒÔ÷ ”–œ¬¡–øÚÕº÷–µƒ◊™ªØπÿœµ£¨∆‰÷–º◊Œ™10µÁ◊”Œ¢¡£°£
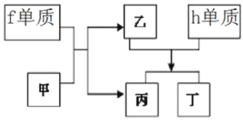
¢Ÿ∂° Ù”⁄________£®—°ÃÓ°∞¿Î◊”ªØ∫œŒÔ°±ªÚ°∞π≤º€ªØ∫œŒÔ°±£©°£
¢⁄«Î–¥≥ˆhµ•÷ ”Γ“∑¥”¶µƒ¿Î◊”∑Ω≥à Ω________
°æ¥∞∏°ø![]() µ⁄∂˛÷Ð∆⁄µ⁄VIA◊ O=C=O Cl©Å£æO2©Å£æMg2+ KOH£æNaOH£æMg(OH)2 KOH+HClO4KClO4+H2O NH3+HNO3NH4NO3 ¿Î◊”ªØ∫œŒÔ 2Al+2OH©Å+2H2O2AlO2©Å+3H2°¸
µ⁄∂˛÷Ð∆⁄µ⁄VIA◊ O=C=O Cl©Å£æO2©Å£æMg2+ KOH£æNaOH£æMg(OH)2 KOH+HClO4KClO4+H2O NH3+HNO3NH4NO3 ¿Î◊”ªØ∫œŒÔ 2Al+2OH©Å+2H2O2AlO2©Å+3H2°¸
°æΩ‚Œˆ°ø
”…‘™Àÿ‘⁄÷Ð∆⁄±Ì÷–µƒŒª÷√ø…÷™£¨aŒ™H£¨bŒ™C£¨cŒ™N£¨dŒ™O£¨eŒ™Ne£¨fŒ™Na£¨gŒ™Mg£¨hŒ™Al£¨mŒ™S£¨nŒ™Cl£¨pŒ™K£¨æð¥ÀΩ‚¥°£
£®1£©mŒ™S£¨÷ ◊” ˝Œ™16£¨“ı¿Î◊”Œ™¡Ú‘≠◊”µ√µΩ2∏ˆµÁ◊”£¨∫ÀÕ‚µÁ◊” ˝Œ™18£¨Ω·ππ æ“‚ÕºŒ™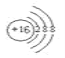 £ª¥∞∏Œ™
£ª¥∞∏Œ™![]() °£
°£
£®2£©dŒ™O£¨—ı‘≠◊” «8∫≈‘™Àÿ£¨∫Àƒ⁄÷ ◊” ˝Œ™8£¨∫ÀÕ‚”–2∏ˆµÁ◊”≤„£¨µ⁄“ª≤„2∏ˆµÁ◊”£¨µ⁄∂˛≤„6∏ˆµÁ◊”£¨‘⁄÷Ð∆⁄±Ì÷–µƒŒª÷√Œ™µ⁄∂˛÷Ð∆⁄µ⁄VIA◊£ª¥∞∏Œ™µ⁄∂˛÷Ð∆⁄µ⁄VIA◊°£
£®3£©bŒ™C£¨◊Ó∏þº€—ıªØŒÔŒ™∂˛—ıªØú£¨CO2 «π≤º€ªØ∫œŒÔ£¨Ãº‘≠◊”∫Õ—ı‘≠◊”÷ƺ‰”–2∂‘π≤”√µÁ◊”∂‘£¨∆‰µÁ◊” ΩŒ™![]() £¨Ω·ππ ΩŒ™O=C=O£ª¥∞∏Œ™O=C=O°£
£¨Ω·ππ ΩŒ™O=C=O£ª¥∞∏Œ™O=C=O°£
£®4£©dŒ™O‘™Àÿ£¨gŒ™Mg‘™Àÿ£¨nŒ™Cl‘™Àÿ£¨æþ”–œýÕ¨µÁ◊”≈≈≤ºµƒ¿Î◊”£¨‘≠◊”–Ú ˝¥Ûµƒ¿Î◊”∞Îæ∂–°£¨‘ÚO°¢Mg–Œ≥…µƒºÚµ•¿Î◊”æþ”–œýÕ¨µÁ◊”≈≈≤º£¨À¸√«µƒ∞Îæ∂¥Û–°Œ™O2-£æMg2+£¨µÁ◊”≤„ ˝‘Ω∂ý£¨∞Îæ∂‘Ω¥Û£¨Cl-£æO2-£¨À˘“‘Cl-£æO2-£æMg2+£ª¥∞∏Œ™Cl-£æO2-£æMg2+°£
£®5£©fŒ™Na‘™Àÿ£¨gŒ™Mg‘™Àÿ£¨pŒ™K‘™Àÿ£¨Na°¢Mg Ù”⁄Õ¨÷Ð∆⁄‘™Àÿ£¨¥”◊Û÷¡”“£¨Ω Ù–‘ºı»ı£¨Ω Ù–‘Na£æMg£¨Na°¢K Ù”⁄Õ¨÷˜◊‘™Àÿ£¨¥”…œÕ˘œ¬£¨Ω Ù–‘‘ˆ«ø£¨Ω Ù–‘K£æNa£¨À˘“‘Ω Ù–‘K£æNa£æMg£¨Ω Ù–‘‘Ω«ø£¨◊Ó∏þº€—ıªØŒÔµƒÀƪ،ԺӖ‘‘Ω«ø£¨‘Ú◊Ó∏þº€—ıªØŒÔµƒÀƪ،ԺӖ‘Œ™KOH£æNaOH£æMg(OH)2£ª¥∞∏Œ™KOH£æNaOH£æMg(OH)2°£
£®6£©pŒ™K‘™Àÿ£¨◊Ó∏þº€—ıªØŒÔµƒÀƪ،Ԍ™KOH£¨nŒ™Cl‘™Àÿ£¨◊Ó∏þº€—ıªØŒÔµƒÀƪ،Ԍ™HClO4£¨¡Ω’þ∑¥”¶µƒªØ—ß∑¥”¶∑Ω≥Ã ΩŒ™KOH+HClO4KClO4+H2O£ª¥∞∏Œ™KOH+HClO4KClO4+H2O°£
£®7£©cŒ™N‘™Àÿ£¨À¸µƒ«‚ªØŒÔŒ™NH3£¨À¸µƒ◊Ó∏þº€—ıªØŒÔ∂‘”¶Àƪ،Ԍ™HNO3£¨¡Ω’þ∑¥”¶µƒªØ—ß∑Ω≥Ã ΩŒ™NH3+HNO3NH4NO3£ª¥∞∏Œ™NH3+HNO3NH4NO3°£
£®8£©”…◊™ªØπÿœµø…÷™fŒ™Na£¨º◊Œ™10µÁ◊”Œ¢¡££¨”÷ƒÐ”ÎNa∑¥”¶£¨‘Úº◊Œ™H2O£¨““Œ™NaOH£¨hŒ™Al£¨Al”ÎNaOH∑¥”¶…˙≥…±˚£¨ø…÷™±˚H2£¨‘Ú∂°Œ™NaAlO2£¨
¢Ÿ∂°Œ™NaAlO2£¨∫¨¿Î◊”º¸£¨Œ™¿Î◊”ªØ∫œŒÔ£ª¥∞∏Œ™¿Î◊”ªØ∫œŒÔ°£
¢⁄Al”ÎNaOH∑¥”¶µƒ¿Î◊”∑Ω≥Ã ΩŒ™£∫2Al+2OH©Å+2H2O2AlO2©Å+3H2°¸£ª¥∞∏Œ™2Al+2OH©Å+2H2O2AlO2©Å+3H2°¸°£

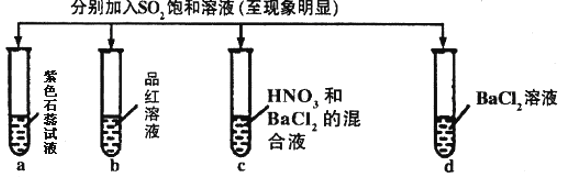
°æƒø°øœ¬¡–”–πÿSO2µƒ–‘÷ µƒÃΩæø µ—ȱ®∏ʺ«¬ºµƒ µ—Èœ÷œÛ’˝»∑µƒ «
µ—È |
| ||||
º«¬º | A | ŒÞ…´ | ŒÞ…´ | ŒÞ…´»Ð“∫ | ŒÞ…´»Ð“∫ |
B | ∫Ï…´ | ŒÞ…´ | ∞◊…´≥¡µÌ | ∞◊…´≥¡µÌ | |
C | ∫Ï…´ | ŒÞ…´ | ∞◊…´≥¡µÌ | ŒÞ…´»Ð“∫ | |
D | ŒÞ…´ | ŒÞ…´ | ŒÞ…´»Ð“∫ | ŒÞ…´»Ð“∫ | |
A.AB.BC.CD.D