��Ŀ����
����Ŀ������Ũ�Ⱦ�Ϊ0.1 mol��L��1��������Һ�������ᡢ�ڴ��ᡢ���������ơ����Ȼ�李��ݴ���李���������李��߰�ˮ����ش��������⣺
��1���١��ڡ��ۡ���������Һ����ˮ�������H��Ũ���ɴ�С��˳����(�����)___________��
��2���ܡ��ݡ��ޡ���������Һ��NH![]() Ũ���ɴ�С��˳����(�����)_______________��
Ũ���ɴ�С��˳����(�����)_______________��
��3�����ۺܰ͢������1��2��Ϻ��Һ�и�����Ũ���ɴ�С��˳���ǣ�__________________��
��4����֪t ��ʱ��KW��1��10��13����t ��(�����������������)________25�档��t ��ʱ��pH��11��NaOH��Һa L��pH��1��H2SO4��Һb L���(���Ի�Ϻ���Һ����ı仯)�������û����Һ��pH��2����a��b��________��
���𰸡� �ܢڢۢ� �ޢܢݢ� c(Cl��)>c(NH![]() )>c(Na��)>c(OH��)>c(H��) > 9��2
)>c(Na��)>c(OH��)>c(H��) > 9��2
�������������������1���Ȼ��Ϊǿ�������Σ�ˮ��ٽ�ˮ�ĵ��룬����Ϊ���ᣬ��Һ��������Ũ�Ƚ�С���������������Ϊǿ����ʣ�Ũ����ͬʱ�������ˮ�ĵ������Ƴ̶Ƚϴ�2���Ȼ�李�����李����������Һ�ж�����![]() ���Ȼ������ǿ����ʣ�����ȫ���룬������林��ڴ����������ӣ�����笠����ӵ�ˮ�⣬�����Ϊ����ǿ���Σ���ٽ�ˮ�⣬笠�����Ũ�����ˮΪ������ʣ����Ե��룬���笠�����Ũ����С����3����Ϻ���Һ����Ϊ�Ȼ��ƺ��Ȼ�李���ˮ���������غ��֪������Ũ�ȴ���笠�����Ũ�ȣ�������Һ�д���һˮ�ϰ������笠����Ӻ����������ӣ�һˮ�ϰ��ĵ���̶ȴ���笠�����ˮ��̶ȣ���笠�����Ũ�ȴ��������ӵ�Ũ�ȣ���Һ�ʼ��ԣ�������������Ũ�ȴ���������Ũ�ȣ���4��ˮ����Ϊ���ȹ��̣������¶ȴٽ����룬ˮ���ӻ�������������t������25����t��ʱ����������Ũ��
���Ȼ������ǿ����ʣ�����ȫ���룬������林��ڴ����������ӣ�����笠����ӵ�ˮ�⣬�����Ϊ����ǿ���Σ���ٽ�ˮ�⣬笠�����Ũ�����ˮΪ������ʣ����Ե��룬���笠�����Ũ����С����3����Ϻ���Һ����Ϊ�Ȼ��ƺ��Ȼ�李���ˮ���������غ��֪������Ũ�ȴ���笠�����Ũ�ȣ�������Һ�д���һˮ�ϰ������笠����Ӻ����������ӣ�һˮ�ϰ��ĵ���̶ȴ���笠�����ˮ��̶ȣ���笠�����Ũ�ȴ��������ӵ�Ũ�ȣ���Һ�ʼ��ԣ�������������Ũ�ȴ���������Ũ�ȣ���4��ˮ����Ϊ���ȹ��̣������¶ȴٽ����룬ˮ���ӻ�������������t������25����t��ʱ����������Ũ��![]() ��t��ʱ��pH��11��NaOH��Һa L��pH��1��H2SO4��Һb L��ϣ������û����Һ��pH��2����
��t��ʱ��pH��11��NaOH��Һa L��pH��1��H2SO4��Һb L��ϣ������û����Һ��pH��2����![]()

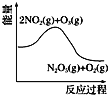
����Ŀ����������������������Լ�����������ӦΪ2NO2(g)��O3(g) ![]() N2O5(g)��O2(g)������Ӧ�ں����ܱ������н��У������ɸ÷�Ӧ���ͼ���������ж���ȷ���� �� ��
N2O5(g)��O2(g)������Ӧ�ں����ܱ������н��У������ɸ÷�Ӧ���ͼ���������ж���ȷ���� �� ��
A | B | C | D |
|
|
|
|
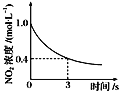
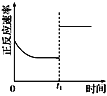
0��3s�ڣ���Ӧ����v(O3)��2mol��L��1��s��1 | �����¶ȣ�ƽ�ⳣ������ | t1ʱ�����������ƽ�������ƶ� | ��ƽ��ʱ�����ı�x����xΪc(O2) |
A. A B. B C. C D. D
����Ŀ�����ұ��ṩ���ݼ�������ʽṹ֪ʶ����Ӧ��SiCl4(g)+2H2(g)��Si(s)+4HCl(g)������1mol
��������ЧӦ��
��ѧ�� | Si-Cl | H-H | Si-Si | H-Cl |
����(kJ/mol) | 360 | 436 | 176 | 431 |
A.����236kJB.�ų�236kJC.�ų�116kJD.����116kJ