题目内容
【题目】某温度下,Fe(OH)3(s)、Cu(OH)2(s)分别在溶液中达到沉淀溶解平衡后,改变溶液pH,金属阳离子浓度的变化如图所示。据图分析,下列判断错误的是
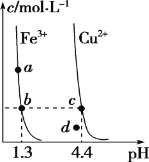
A. Ksp[Fe(OH)3]<Ksp[Cu(OH)2]
B. 加适量NH4Cl固体可使溶液由a点变到b点
C. c、d两点代表的溶液中c(H+)与c(OH-)乘积相等
D. 在b、c两点代表的溶液中Fe(OH)3、Cu(OH)2分别达到饱和
【答案】B
【解析】
根据图象找出可用来比较Fe(OH)3、Cu(OH)2溶度积常数点,可用b、c进行计算;由a点变到b点,PH增大,氯化铵水解呈酸性,不会增大溶液的PH;Kw只与温度有关;注意分析处在曲线上的点与曲线外的点有什么区别。
A项,b点pH=1.3,c(OH-)=10-12.7mol/L,有Ksp[Fe(OH)3]=c(Fe3+)×c3(OH-)=(10-12.7)3 c(Fe3+),c点时pH=4.4,c(OH-)=10-9.6mol/L,有Ksp[Cu(OH)2]=c(Cu2+)× c2(OH-)=(10-9.6)2 c(Cu2+),溶液在b、c两点时c(Fe3+)= c(Cu2+),可知Ksp[Fe(OH)3]<Ksp[Cu(OH)2],故A正确;
B项,溶液由a点变到b点即溶液pH变大,但由于铵根离子在溶液中会水解而显酸性,向溶液中加入适量氯化铵会使溶液pH值变小,因此不能使溶液由a点变到b点,故B错误;
C项,因为温度不变,所以该溶液中c(H+)与c(OH-)的乘积,即水的离子积常数KW不变,故C正确;
D项,b、c两点均在沉淀溶解平衡曲线上,因此这时的溶液均达到饱和,故D项正确。
综上所述,本题选B。

练习册系列答案
相关题目