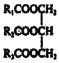题目内容
【题目】Ⅰ、目前已开发出用电解法制取ClO2的新工艺。
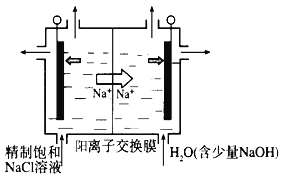
(1)图中用石墨做电极,在一定条件下电解饱和食盐水制取ClO2。则阳极产生ClO2的电极反应式为___________________________________________。
(2)电解一段时间,当阴极产生的气体体积为112 mL(标准状况)时,停止电解。通过阳离子交换膜的阳离子的物质的量为________mol。
Ⅱ、某研究性学习小组根据反应:2KMnO4+10FeSO4+8H2SO4===2MnSO4+5Fe2(SO4)3+K2SO4 + 8H2O设计如下原电池,其中甲、乙两烧杯中各物质的物质的量浓度均为 1 mol·L-1,溶液的体积均为200 mL,盐桥中装有饱和K2SO4溶液。

回答下列问题:
(3)此原电池的正极是石墨________(填“a”或“b”)。
(4)电池工作时,盐桥中的SO![]() 移向________(填“甲”或“乙”)烧杯。
移向________(填“甲”或“乙”)烧杯。
(5)甲烧杯中的电极反应式为_______________________。
(6)若不考虑溶液的体积变化,MnSO4浓度变为1.5 mol·L-1,则反应中转移的电子为____mol。
【答案】 Cl--5e-+2H2O===ClO2↑+4H+ 0.01 a 乙 MnO![]() +5e-+8H+===Mn2++4H2O 0.5
+5e-+8H+===Mn2++4H2O 0.5
【解析】试题分析:Ⅰ、(1)阳极Cl-失去电子发生氧化反应生成ClO2。(2)水电离产生的H+在阴极上放电产生氢气,转移电子的物质的量n=2n(H2)=2×(0.112 L÷22.4 L·mol-1)=0.01 mol,根据电荷守恒分析转移阳离子的物质的量。Ⅱ、(3)原电池中发生氧化反应的一极是负极,发生还原反应的一极是正极;(4)原电池中阳离子移向正极、阴离子移向负极;(5)甲烧杯中MnO![]() 得电子被还原为Mn2+; (6) MnSO4浓度由1 mol·L-1变为1.5 mol·L-1,则生成MnSO4的物质的量是0.2L×(1.5 mol·L-1-1 mol·L-1)=0.1mol,根据电极反应式计算转移电子的物质的量。
得电子被还原为Mn2+; (6) MnSO4浓度由1 mol·L-1变为1.5 mol·L-1,则生成MnSO4的物质的量是0.2L×(1.5 mol·L-1-1 mol·L-1)=0.1mol,根据电极反应式计算转移电子的物质的量。
解析:Ⅰ、(1)阳极Cl-失去电子发生氧化反应生成ClO2,电极反应是Cl--5e-+2H2O===ClO2↑+4H+。(2)水电离产生的H+在阴极上放电产生氢气,转移电子的物质的量n=2n(H2)=2×(0.112 L÷22.4 L·mol-1)=0.01 mol,溶液中阳离子全是+1价离子,根据电荷守恒,通过阳离子交换膜的阳离子的物质的量为0.01mol。Ⅱ、(3)原电池中发生氧化反应的一极是负极,发生还原反应的一极是正极;根据电池总反应方程式,KMnO4得电子发生还原反应,FeSO4失电子发生氧化反应;所以原电池的正极是石墨a; (4)原电池中阳离子移向正极、阴离子移向负极,所以盐桥中的SO![]() 移向乙烧杯;(5)甲烧杯中MnO
移向乙烧杯;(5)甲烧杯中MnO![]() 得电子被还原为Mn2+,电极反应是MnO
得电子被还原为Mn2+,电极反应是MnO![]() +5e-+8H+===Mn2++4H2O; (6) MnSO4浓度由1 mol·L-1变为1.5 mol·L-1,则生成MnSO4的物质的量是0.2L×(1.5 mol·L-1-1 mol·L-1)=0.1mol,根据电极反应MnO
+5e-+8H+===Mn2++4H2O; (6) MnSO4浓度由1 mol·L-1变为1.5 mol·L-1,则生成MnSO4的物质的量是0.2L×(1.5 mol·L-1-1 mol·L-1)=0.1mol,根据电极反应MnO![]() +5e-+8H+===Mn2++4H2O,生成0.1mol MnSO4转移电子的物质的量是0.5mol。
+5e-+8H+===Mn2++4H2O,生成0.1mol MnSO4转移电子的物质的量是0.5mol。

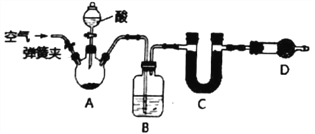
【题目】用图中所示装置进行实验,实验现象与预测不一致的是( )
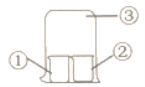
①中的物质 | ②中的物质 | 预测现象 | |
A | 饱和亚硫酸 | 蓝色石蕊试液 | ②中溶液先变红色又褪色 |
B | 饱和氯水 | 湿润红纸条 | ②中红纸条褪色 |
C | 浓双氧水 | H2S溶液 | ②中有淡黄色沉淀 |
D | 浓氨水 | 浓盐酸 | ③中有白烟 |
A. A B. B C. C D. D