��Ŀ����
����Ŀ��I.��֪ij���������к�������NaCl��Ϊ��ȷ�������д���������������ɲⶨ���ڻ�ѧ��Ӧ������CO2��������ʵ��װ�����£�����̨���г���������ʡ�ԣ���
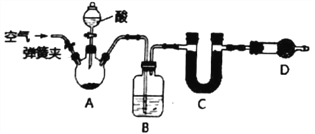
���������գ�
��1��Bװ���е��Լ���_____________��������_____________________________��
��2��Dװ�õ�������___________________________________��
II.�ⶨ�����д�������������ij��ʵ�鲽�����£��ٽ�10.000g������������A�� �ڳ���C��U��+��ʯ�ң���ͬ��������Ϊl05.160g ��ʹ�÷�Һ©���μ��������ᣬʹ��ַ�Ӧ �ܴ�A�ĵ��ɼУ���������һ�����Ŀ��� ���ٴγ���C ���ظ�����ܺ͢ݣ����õ�C������Ϊ109.l66g��
��3��������У��μӵ������ѡ��________��
a��Ũ���� b��ϡ���� c��Ũ���� d��ϡ����
������____________________����ʱ���ɽ��еڢܲ�������
��4�������Ŀ����_______________________________________________��
��5����ʵ�����ݿ�֪�������д������������Ϊ_________________������3λС������
��6����ͬѧ������װ�òⶨij�����д�����������������ƫ�ߣ���������ҳ����ʵ������ԭ��_______________________________________________��
���𰸡� Ũ���� ����CO2���� ��ֹ�����е�ˮ������CO2�������C�и���ʵ��IJⶨ��� d A�в��ٲ������� �жϷ�Ӧ������CO2�����Ƿ�ȫ���ų�������U���еļ�ʯ�������� 0.965 ����Ŀ����к���CO2�ȣ���������
��������I.��1����Ʒ�м����ᣬ̼�������ᷴӦ���ɶ�����̼������ˮ�������ʣ���˻������Ҫͨ��Ũ���������ˮ��Ȼ�����ü�ʯ�����ն�����̼���壬������������̼������������Bװ���е��Լ���Ũ���ᣬ����CO2���� ����ȷ����Ũ��� ����CO2���� ��
��2��Dװ����ʢ�ŵļ�ʯ�ң��������Ƿ�ֹ�����е�ˮ������CO2�������C�и���ʵ��IJⶨ�������ȷ�𰸣���ֹ�����е�ˮ������CO2�������C�и���ʵ��IJⶨ�����
II.��3��Ũ������ϡ���� �����лӷ��������������������Ȼ��������������Ӱ��ʵ�����IJⶨ��Ũ��������ˮ�ų��������ȣ���Ӧ����̫�죬��ʯ�����ն�����̼���岻��ȫ������ʵ����ϡ�����ӷ����Һ���Ʒ��Ӧ�������ˣ�ʵ��Ч���ã���˲�����У��μӵ������ѡ��ϡ���ᣬ������A�в��ٲ�������ʱ�����ɽ��еڢܲ���������ȷ�𰸣�d ��A�в��ٲ������塣
��4������������ظ�����ܺ͢ݣ��ٴγ���C�������������ֵ�������ķ�Χ����˵����Ӧ������CO2�����Ѿ�ȫ���ų�������U���еļ�ʯ������������ȷ�����жϷ�Ӧ������CO2�����Ƿ�ȫ���ų�������U���еļ�ʯ����������
��5��װ��C���ӵ�����Ϊ��Ӧ����������̼��������������Զ�����̼����Ϊ��109.l66- l05.160��/44=0.091mol�����ݷ�Ӧ����ʽ��Na2CO3+H2SO4=Na2SO4+CO2��+H2O��֪��̼���Ƶ���Ϊ0.091mol������Ϊ0.091��106=9.65g�������д������������Ϊ9.65/10.000��100%=96.5%����ȷ����96.5%�� 0.965��
��6������Ŀ����к���CO2�����װ��C�����յĶ�����̼������������̼��������ƫ���ƫ�ߣ���ȷ�𰸣�����Ŀ����к���CO2�ȣ�����������

 ���Ǽ���С����ϵ�д�
���Ǽ���С����ϵ�д�