题目内容
18.在50mL 4mol/L的氢氧化钠溶液中,通入一定量的硫化氢,反应完毕,在常温减压条件下,用氮气把溶液吹干,得到白色固体7.92g,通过计算确定白色固体的组成及各组分的质量.分析 NaOH的物质的量为:0.05L×4mol/L=0.2mol,0.2mol的NaOH跟H2S反应,若全部生成Na2S时,白色固体的质量为:78g/mol×$\frac{0.2mol}{2}$=7.8g,0.2mol的NaOH跟H2S反应,若全部生成aHS时,白色固体(NaHS)的质量为:56g/mol×0.2mol=11.2g,因为7.8g<7.92g<11.2g,所以得到的白色固体有两种可能的组合:一种是Na2S和NaOH的混合物;另一种是Na2S和NaHS的混合物,根据题意列方程式进行计算即可.
解答 解:NaOH的物质的量为:0.05L×4mol/L=0.2mol,0.2mol的NaOH跟H2S反应,若全部生成Na2S时,白色固体的质量为:78g/mol×$\frac{0.2mol}{2}$=7.8g,0.2mol的NaOH跟H2S反应,若全部生成aHS时,白色固体(NaHS)的质量为:56g/mol×0.2mol=11.2g,因为7.8g<7.92g<11.2g,所以得到的白色固体有两种可能的组合,
一种是Na2S和NaOH的混合物;另一种是Na2S和NaHS的混合物.
设Na2S为xmol,则有(0.2-2x)mol NaOH,78g/mol×xmol+40g/mol(0.2-2x)=7.92g,x=0.04mol
Na2S的质量:0.04mol×78g/mol=3.12g,NaOH的质量:7.92g-3.12g=4.80g.
设Na2S为ymol,则有(0.2-2y)mol NaHS.
78g/mol×ymol+56g/mol(0.2-2y)mol=7.92g
y=0.0965mol
Na2S的质量为:78g/mol×0.0965mol=7.52g
NaHS的质量为:7.92g-7.52g=0.40g
答:白色固体有一种是由Na2S(3.12g)和NaOH(4.80g)组成的混合物.另一种是由Na2S(7.52g)和NaHS(0.40g)组成的混合物.
点评 本题考查学生有关混合物的计算知识,注意极值法的应用是难点,学会运用所学知识进行分析和推理能力是关键所在.

| A. | $\frac{2b-c}{2a}$ | B. | $\frac{2b-c}{a}$ | C. | $\frac{2b-c}{3a}$ | D. | $\frac{2b-c}{6a}$ |
| A. | 6.8g液态KHSO4中含有0.1NA个阳离子 | |
| B. | NA个Fe(OH)3胶体粒子形成的纳米材料的质量为107g | |
| C. | 含有4.6g钠元素的 过氧化钠的混合物中,所含离子总数为0.3NA | |
| D. | 5NH4NO3═2HNO3+4N2↑+9H2O反应中,生成28gN2时,转移的电子数为15NA |
| A. | 0.8mol•L-1 | B. | 0.4mol•L-1 | C. | 0.08mol•L-1 | D. | 0.04mol•L-1 |

| A. | 其分子式为C15H16O2 | |
| B. | 它有弱酸性,且能和酸性高锰酸钾溶液反应 | |
| C. | 它常温下呈液态,不溶于水,是苯酚的同系物 | |
| D. | 该有机物分子中碳原子不可能在同一平面上 |
| 族 周期 | IA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 二 | ① | ② | ③ | ④ | ||||
| 三 | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | ⑩ |
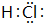 .
.(2)非金属性最强的元素是F(填元素符号,下同),形成化合物种类最多的元素是C.
(3)第三周期元素除⑩外原子半径最小的是Cl(填元素符号),这些元素的最高价氧化物对应水化物中碱性最强的是NaOH(填化学式,下同),具有两性的是Al(OH)3.
(4)⑤⑥⑦单质的活泼性顺序为Na>Mg>Al (填元素符号),判断的实验依据是单质与水或酸反应的剧烈程度 (至少写出一种).
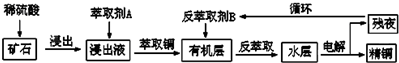
 CuCl是应用广泛的有机合成催化剂,也在染料工业中用作实效型气体吸收剂.利用废旧印刷电路板制氯化亚铜可减少污染、实现资源再生.请回答下列问题:
CuCl是应用广泛的有机合成催化剂,也在染料工业中用作实效型气体吸收剂.利用废旧印刷电路板制氯化亚铜可减少污染、实现资源再生.请回答下列问题: