题目内容
【题目】在标准状况下,①5 g H2 ②11.2 L O2 ③2 mol H2O ④6.02×1023个 CO2分子。
(1)5gH2 的物质的量是_______,体积是_______;
(2)6.02×1023个CO2分子的物质的量是_____,质量是______;
(3)所含分子数最多的是______(请用序号回答,后同);
(4)所含原子数最多的是______;
(5)质量最大的是_______;
(6)体积最大的是_______;
(7) 体积最小的是_______。
【答案】2.5mol 56L 1mol 44g ① ③ ④ ① ③
【解析】
根据已知信息可得:①n(H2)=![]() =
=![]() =2.5mol;②n(O2)=
=2.5mol;②n(O2)=![]() =
=![]() =0.5mol;③n(H2O)=2mol;④n(CO2)=
=0.5mol;③n(H2O)=2mol;④n(CO2)=![]() =
=![]() =1mol;根据物质的量与微粒的数目、体积、质量之间的关系解题。
=1mol;根据物质的量与微粒的数目、体积、质量之间的关系解题。
根据已知信息可得:①n(H2)=![]() =
=![]() =2.5mol;②n(O2)=
=2.5mol;②n(O2)=![]() =
=![]() =0.5mol;③n(H2O)=2mol;④n(CO2)=
=0.5mol;③n(H2O)=2mol;④n(CO2)=![]() =
=![]() =1mol;
=1mol;
(1)n(H2)=![]() =
=![]() =2.5mol,V(H2)= n(H2)×22.4L/mol=2.5mol ×22.4=56L,
=2.5mol,V(H2)= n(H2)×22.4L/mol=2.5mol ×22.4=56L,
故答案为:2.5mol;56L;
(2)6.02×1023个CO2分子的物质的量n(CO2)=![]() =
=![]() =1mol,质量是1mol×44g/mol=44g,
=1mol,质量是1mol×44g/mol=44g,
故答案为:1mol;44g;
(3)分子数与分子的物质的量成正比,由上面分析可知,所含分子数最多的是①,
故答案为:①;
(4)原子数等于分子数乘以原子的数目:① 2.5 NA ×2=5NA、②0.5NA×2= NA、③ 2NA ×3=6NA、④NA×3=3NA
故答案为:③;
(5)质量:①5g、②0.5×32g/mol=16g、③2mol×18g/mol= 36g、④1mol ×44g/mol=44g,
故答案:④;
(6)相同条件下,气体物质的量越大,气体的体积越大,液体的的体积最小,
故答案为:①;
(7)相同条件下,气体物质的量越大,气体的体积越大,液体的的体积最小,
故答案为:③。

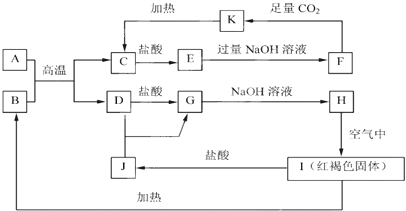
【题目】Na、Al、Fe、Cu是中学化学中重要的金属元素。它们的单质及其化合物之间有很多转化关系。下表所列物质不能按如图(“→”表示一步完成)关系相互转化的是 ( )
选项 | A | B | C | D |
|
a | Na | Al | Fe | Cu | |
b | NaOH | Al2O3 | FeCl3 | CuSO4 | |
c | NaCl | Al(OH)3 | FeCl2 | CuCl2 |
A. AB. BC. CD. D
【题目】PdCl2广泛用作催化剂和一些物质的检测试剂。由Pd(NH3)2Cl2制备PdCl2工艺流程如图所示。

(1)肼(N2H4)可以被看作二元弱碱,结合质子生成N2H5+或N2H62+。肼与少量稀硫酸混合后,得到产物的化学式为___。
(2)对工艺流程图中的滤液处理办法最好的是:___
a.返到提钯废液中,循环使用 b.转化为无毒物质后排放 c.深埋于地下
(3)王水溶钯时,Pd被氧化为H2PdCl4。同时得到唯一还原产物亚硝酰氯(NOCl)。反应消耗的HCl与HNO3的物质的量之比为___。
(4)赶硝,是将残余的NO3浓度降低到不大于0.04%。实验数据记录如表:
表一:不同HCl用量和MxOy用量(每10gPd)与NO3残留量
HCl用量(mL) | MxOy用量(mL) | NO3含量(%) |
5 | 0、10、20、30、40 | 0.15、0.10、0.05、0.04、0.03 |
10 | 0、5、10、15、20 | 0.10、0.08、0.05、0.03、0.02 |
15 | 0、5、10、15、20 | 0.08、0.06、0.05、0.03、0.02 |
处理1吨Pd,需要用到HCl和MxOy的总体积至少为___m3(合理选择表格里相关数据计算)。
(5)煅烧过程发生分解反应,化学方程式为:___。
(6)浸有磷钼酸铵溶液的氯化钯试纸遇微量CO立即变成蓝色。原理较为复杂,第一步是CO还原PdCl2得到Pd单质,同时有常见的氧化物生成。写出反应原理中第一步的化学方程式:___