题目内容
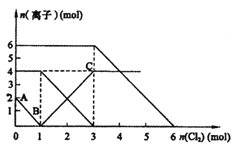
【题目】已知A~K均为中学化学的常见物质,它们之间的转化关系如下图所示,其中A、D为金属单质,反应过程中生成的水及其他部分产物已略去。
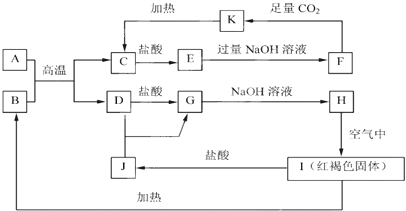
请回答以下问题:
(1)B的主要用途是_________(填一项),C的化学式为______________。
(2)E中阳离子的结构示意图为__________
(3)向F中通入足量CO2生成K的离子方程式是________________________。
(4)J在工业上可用于净水,其原理是__________________ (用离子方程式表示)
【答案】制作铁红等 Al2O3 ![]() AlO2-+CO2+2H2O=Al(OH)3
AlO2-+CO2+2H2O=Al(OH)3 ![]() +HCO3- Fe3++3H2O
+HCO3- Fe3++3H2O ![]() Fe(OH)3(胶体)+3H+
Fe(OH)3(胶体)+3H+
【解析】
I为红褐色固体,应为Fe(OH)3,则H为Fe(OH)2,由转化关系可知G为FeCl2,D为Fe,J为FeCl3,B为Fe2O3,A和B的反应为铝热反应,A为Al,C为Al2O3,E为AlCl3,K为Al(OH)3,F为NaAlO2
(1)B为Fe2O3,B的主要用途是制作铁红等,C的化学式为Al2O3。
(2)E为AlCl3,阳离子为Al3+,离子的结构示意图为![]() ;
;
(3)向F中通入足量CO2生成K,即:向NaAlO2中通入足量CO2生成AlOH)3的离子方程式为AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-;
(4)J在工业上可用于净水,其原理是:铁盐可作絮凝剂,常用于净水,其原理是Fe3++3H2O![]() Fe(OH)3+3H+,生成胶体,具有吸附性,可净化水。
Fe(OH)3+3H+,生成胶体,具有吸附性,可净化水。

 初中学业考试导与练系列答案
初中学业考试导与练系列答案【题目】(物质结构与性质)元素周期表中第57号元素镧到71号元素镥这15种元素统称为镧系元素。回答下列问题:
(1)钬(Ho)可用来制作磁性材料,其基态原子电子排布式为[Xe]4f116s2,钬(Ho)有___个未成对电子。
(2)钇钡铜氧(YBa2Cu3O7-x)是一种高温超导材料(其中Y显+3价,Cu显+2、+3价),该材料所含元素中,电负性最大的元素是______(填元素符号),若YBa2Cu3O7-x材料在T ℃下有超导性,当x=0.2时,n(Cu3+)∶n(Cu2+)=_____。
(3)下表是几种镧系元素的电离能(单位:kJ·mol-1)
第一电离能 | 第二电离能 | 第三电离能 | 第四电离能 | |
Ce | 527 | 1047 | 1949 | 3547 |
La | 538 | 1067 | 1850 | 4819 |
Lu | 532 | 1340 | 2022 | 4370 |
Yb | 604 | 1174 | 2417 | 4203 |
据此,判断形成+3价化合物最稳定的元素是____(填元素符号)。
(4)Sm(钐)的单质与l,2-二碘乙烷可发生如下反应:Sm+ICH2CH2I→SmI2+CH2=CH2。ICH2CH2I中碳原子杂化轨道类型为____,1 mol CH2=CH2中含有的σ键数目为_______;常温下l,2-二碘乙烷为液体而乙烷为气体,其主要原因是_____。
(5)从磷钇矿中可提取稀土元素钇(Y),某磷钇矿的结构如图。
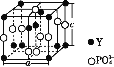
该磷钇矿的化学式为____,与PO43-互为等电子体的阴离子有____(写出两种离子的化学式)。已知晶胞参数a=0.69 nm,c=0.60 nm,阿伏加德罗常数为NA,则晶胞的密度为____g·cm-3(列出计算式)。