题目内容
14.依据事实,写出下列反应的热化学方程式.(1)在25℃、101kPa下,1g乙醇燃烧生成CO2和液态水时放热29.7kJ.则表示乙醇燃烧热的热化学方程式为C2H5OH(l)+3O2(g)═2CO2(g)+3H2O(l)△H=-1366.2kJ•mol-1.
(2)已知拆开1mol H-H键,1molN-H键,1molN≡N键分别需要的能量是436kJ、391kJ、946kJ,则N2与H2反应生成NH3的热化学方程式为N2(g)+3H2(g)?2NH3(g)△H=-92kJ•mol-1.
分析 (1)依据燃烧热的定义解答,表示燃烧热的热化学方程式中可燃物为1mol,产物为稳定氧化物;依据1g乙醇完全燃烧生成CO2和液态水时放热23kJ,结合燃烧热的定义计算求出1mol乙醇完全燃烧放出的热量,然后写出热化学方程式;
(2)化学反应中,化学键断裂吸收能量,形成新化学键放出能量,根据方程式计算分别吸收和放出的能量,以此计算反应热并判断吸热还是放热.
解答 解:(1)燃烧热是指:在25℃、101KPa时,1mol纯净物完全燃烧生成稳定的氧化物放出的热量,1g乙醇完全燃烧生成CO2和液态水时放热29.7kJ,则1mol乙醇,质量为46g,完全燃烧生成稳定的氧化物放出的热量为:46×29.7kJ=1366.2kJ,
其燃烧热的热化学方程式为:C2H5OH(l)+3O2(g)═2CO2(g)+3H2O(l)△H=-1366.2kJ•mol-1;
故答案为:C2H5OH(l)+3O2(g)═2CO2(g)+3H2O(l)△H=-1366.2kJ•mol-1;
(2)在反应N2+3H2?2NH3中,断裂3molH-H键,1mol N三N键共吸收的能量为:3×436kJ+946kJ=2254kJ,生成2mol NH3,共形成6mol N-H键,放出的能量为:6×391kJ=2346kJ,吸收的能量少,放出的能量多,该反应为放热反应,放出的热量为:2346kJ-2254kJ=92kJ,
故答案为:N2(g)+3H2(g)?2NH3(g)△H=-92kJ•mol-1.
点评 本题主要考查了热化学方程式的书写,需要注意的有:物质的状态、反应热的数值与单位,反应热的数值与化学方程式前面的系数成正比.同时还考查了反应热的计算,题目难度不大,注意把握从键能的角度计算反应热的方法.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
4.下列表示正确的是( )
| A. | 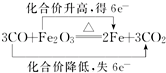 | B. |  | ||
| C. | 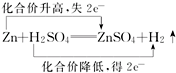 | D. | 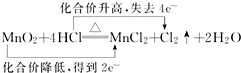 |
9.下列化学反应中水作氧化剂的是( )
| A. | SO2+H2O | B. | Fe+H2O | C. | Cl2+H2O | D. | NO2+H2O |
19.X、Y、Z、R分别代表四种元素,如果aXm+、bYn+、cZn-、dRm- 四种离子的电子层结构相同,则下列关系式正确的是( )
| A. | a-c=m-n | B. | a-b=n-m | C. | c+d=m+n | D. | b-d=n+m |
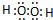 ,该分子含有极性键和非极性键(填“极性”、“非极性”)键
,该分子含有极性键和非极性键(填“极性”、“非极性”)键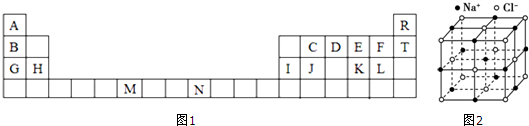
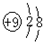 .
.