题目内容
【题目】锗铜合金是一种常用的标准电阻材料,工业生产中会出现一些技术指标达不到要求的合金,为避免资源浪费可利用如下流程对不达标合金中的锗、铜进行回收,请回答相关问题。
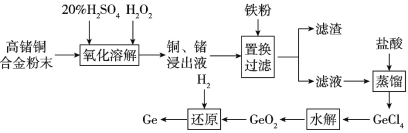
(1)锗在元素周期表中的位置是____。
(2)氧化溶解过程中铜参与反应的离子方程式是___。为加快氧化溶解反应速率可采用的措施有___(任写两种)。
(3)滤渣的成分是_____。
(4)水解过程发生的反应是GeCl4+2H2O=GeO2↓+4HCl,为得到纯净的GeO2,对水解所得混合物要进行过滤、洗涤、干燥等操作,判断GeO2是否洗涤干净的操作是__。
(5)下列金属的冶炼原理与流程中锗的冶炼原理相似的是____(填选项序号)。
A.钠 B.铝 C.铁 D.银
(6)若含锗6.2%的高锗铜合金的质量为50kg,还原过程中参与反应的H2体积为1.792m3(已折合为标准状况),则锗的回收率为____(保留三位有效数字)。
【答案】第四周期ⅣA族 Cu+H2O2+2H+=Cu2++2H2O 搅拌、适当加热、适当增大硫酸浓度 铜、铁 取少量最后一次洗涤液于试管中,滴加HNO3酸化的AgNO3溶液,若不产生白色沉淀,则GeO2已洗涤干净,如果有沉淀,则没有洗涤干净。 C 94.2%
【解析】
(1)锗与碳同族,根据元素周期表,该元素在第四周期ⅣA族,答案为:第四周期ⅣA族;
(2)氧化溶解过程中铜在酸性条件下与双氧水反应生成硫酸铜和水,离子方程式Cu+H2O2+2H+=Cu2++2H2O。为加快氧化溶解反应速率即加快反应速率,可采用的措施有搅拌、适当加热、适当增大硫酸浓度。答案为:Cu+H2O2+2H+=Cu2++2H2O;搅拌、适当加热、适当增大硫酸浓度;
(3)置换过滤过程是用铁置换铜,铁粉会适当过量,因此滤渣成分是铜和过量的铁。
答案为:铜、铁。
(4)根据题干反应GeCl4+2H2O=GeO2↓+4HCl,要检验GeO2是否洗干净,主要检验是否存在氯离子,检验方法为:取少量最后一次洗涤液于试管中,滴加HNO3酸化的AgNO3溶液,若不产生白色沉淀,则GeO2已洗涤干净,如果有沉淀,则没有洗涤干净。
答案为:取少量最后一次洗涤液于试管中,滴加HNO3酸化的AgNO3溶液,若不产生白色沉淀,则GeO2已洗涤干净,如果有沉淀,则没有洗涤干净。
(5)锗的冶炼方法是热还原法,钠、铝的冶炼方法是电解法,铁的冶炼方法是热还原法,银的冶炼方法是热分解法,因此答案选C。
(6)根据质量分数,原合金中锗的质量为3.1kg,还原过程发生反应的方程式是GeO2+2H2![]() Ge+2H2O,根据方程式可算出制得锗的质量为2.92kg,因此锗的回收率=
Ge+2H2O,根据方程式可算出制得锗的质量为2.92kg,因此锗的回收率=![]() ,答案为:94.2%。
,答案为:94.2%。