题目内容
【题目】Ⅰ.(1)把一块纯净的锌片插入盛有稀硫酸的烧杯中,可观察到锌片逐渐溶解,并有气泡产生;平行地插入一块铜片(如图甲装置所示),可观察到铜片上___ (填“有”或“没有”)气泡产生;若用导线把锌片和铜片连接起来(如图乙装置所示),可观察到铜片上____ (填“有”或“没有”)气泡产生。
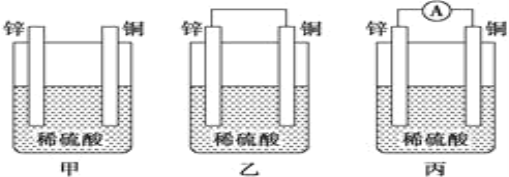
(2)乙、丙装置是将_____能转化为____能的装置,人们把它叫做________。
Ⅱ.将质量相等的锌片和铜片用导线相连,并浸入500 mL硫酸铜溶液中构成如图所示的装置。

(1)该装置中总反应的离子方程式为____________,铜片周围溶液会出现_________的现象。
(2)若2 min后测得锌片质量减少1.3 g,则导线中流过的电子为________mol。
【答案】没有 有 化学 电 原电池 Zn+Cu2+=Zn2++Cu 颜色变浅 0.04
【解析】
根据原电池原理分析装置是否构成原电池,描述电极发生的现象;根据电极反应式计算电子转移数目。
Ⅰ.(1)平行地插入一块铜片,如图甲所示并未形成原电池,铜和稀硫酸不反应,所以铜片上没有气泡产生;用导线把锌片和铜片连接起来,如图乙所示,形成了原电池,铜片作正极,正极反应式为:2H++2e-=H2↑,所以铜片上有气泡产生;
(2)如图所示,乙、丙装置属于原电池,所以是将化学能转变为电能的装置,人们把它叫做原电池;
Ⅱ.(1)该装置中总反应为锌和硫酸铜溶液的反应,离子方程式为Zn+Cu2+=Zn2++Cu;铜片作正极,发生的电极反应为:Cu2++2e-=Cu,所以铜片周围溶液会出现颜色变浅的现象;
(2)n(e-)=2n(Zn)=2×![]() =0.04mol。
=0.04mol。

练习册系列答案
相关题目






