��Ŀ����
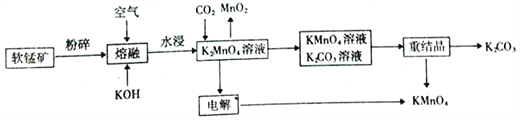
����Ŀ��������ؿ�������������������ѧ��ѧ����������������ҵ��,�����̿�( ��Ҫ�ɷ�MnO2)�Ƹ�����ص���������(���������Ͳ���ʡ��):
��ش��������⣺
��1���ڡ�ˮ���������У����K2MnO4������(������K2MnO4�����롰�ۿ顱����֮��)�Ĵ�ʩ��_______( ����д������)��
��2�������ڡ������з�����Ӧ�Ļ�ѧ����ʽΪ___________��
��3��CO2 ��K2MnO4��Ӧ�����ӷ���ʽΪ___________��
��4������⡱������ʹ�õ��Ƕ��Ե缫����:
��������Ӧ�ķ���ʽΪ__________��
������������Һ��pH��__________��(�������С�� �� ���䡱)��
��5�������������в�����Mn2+��Ի��������Ⱦ����ҵ�ϣ�ͨ������pHʹ��ˮ�е�Mn2+�γ�Mn(OH)2 ��������pH=10ʱ����Һ�е�c(Mn2+)=______(��֪:Ksp[Mn(OH)2]=2.0��10-13��������ݾ��ڳ����²ⶨ)��
���𰸡� �����ۿ顱���顢���ȡ�����ȣ� 2MnO2+O2+4KOH![]() 2K2MnO4+2H2O 3MnO42-+2CO2=2MnO4-+MnO2��+2CO32- MnO42--e-=MnO4- ���� 2.0��10-5mol/L
2K2MnO4+2H2O 3MnO42-+2CO2=2MnO4-+MnO2��+2CO32- MnO42--e-=MnO4- ���� 2.0��10-5mol/L
����������1���ڡ�ˮ���������У����K2MnO4�����ʣ�ʵ�ʾ����Ƴ���ѧϰ����μ����ܽ⣬���Դ��ǽ��裬���ȣ�����ȷ�����
��2�����������������ش������ÿ����е�������MnO2����Ϊ����أ���������һ����ˮ�����ݻ��ϼ�������Ⱥ�ԭ�Ӹ����غ���ƽ�����õ���2MnO2+O2+4KOH![]() 2K2MnO4 + 2H2O��
2K2MnO4 + 2H2O��
��3����ͼ�п������������Һ��ͨ�������̼���壬�õ�������ء��������̺�̼��أ����ݻ��ϼ�������Ⱥ�ԭ�Ӹ����غ���ƽ�����õ���3MnO42-+2CO2=2MnO4-+ MnO2�� + 2CO32-��
��4���ٵ���������Һ��Ŀ���ǵõ�������أ����������ķ�Ӧһ�������������ʧ���ӵõ�����������ӣ���ӦΪ��MnO42--e-=MnO4-��
�ڵ�������Ӧ����ˮ����������ӵõ���ת��Ϊ����������ˮ��������������ӻ�ʣ������Һ�У���Ũ����������������������Һ��pH������
��5����pH=10ʱ����Һ�е�c(H+)=1��10-10mol/L��c(OH-)=1��10-4mol/L�����Ե�pH=10ʱ����Һ�е�c(Mn2+)=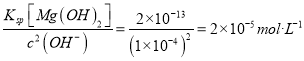 ��
��

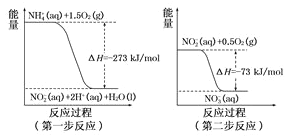
 �Ͻ�ƽ���Ȿϵ�д�
�Ͻ�ƽ���Ȿϵ�д� ����ѧ��Ӧ�����ϵ�д�
����ѧ��Ӧ�����ϵ�д�