题目内容
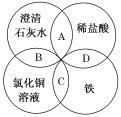
【题目】某试液中只可能含有下列K+、NH4+、Fe2+、Al3+、Cl-、SO42-、CO32-、AlO2-中的若干种离子,离子浓度均为0.1mol·L-1。某同学进行了如下实验:

下列说法正确的是( )
A. 无法确定原试液中是否含有Al3+、Cl-
B. 滤液X中大量存在的阳离子有NH4+、Fe2+和Ba2+
C. 无法确定沉淀C的成分
D. 原溶液中存在的离子为NH4+、Fe2+、Cl-、SO42-
【答案】D
【解析】
根据实验现象分析,加入过量稀硫酸无明显变化,说明无CO32-,无AlO2-;加入硝酸钡有气体,说明有亚铁离子存在且被氧化,沉淀为硫酸钡;加入NaOH有气体,说明存在铵根离子,气体为氨气,沉淀B为红褐色氢氧化铁沉淀;通入少量CO2产生沉淀,溶液呈碱性且含有钡离子,所以沉淀C为碳酸钡,不能说明存在Al3+;因为存在的离子浓度均为0.1mol·L-1,从电荷的角度出发,只能含有NH4+、Fe2+、Cl-、SO42-,才能保证电荷守恒;
A. 通过上述分析,原试液没有Al3+,有Cl-,故A错误;
B. 根据上述分析,滤液X中大量存在的阳离子有NH4+、Ba2+和Fe3+,故B错误;
C. 沉淀C的成分为碳酸钡,故C错误;
D. 根据上述分析原溶液中存在的离子为NH4+、Fe2+、Cl-、SO42-,故D正确,
故选D。

 口算题天天练系列答案
口算题天天练系列答案【题目】现有六种元素,其中 A、B、C、D 为短周期主族元素,E、F 为第四周期元素,它们的原子序数依次增大。
A 元素原子的核外 p 电子数比 s 电子数少 3 |
B 元素形成的物质种类繁多,其形成的一种固体单质工业上常用作切割工具 |
C 元素基态原子 p 轨道有 3 个未成对电子 |
D 原子核外所有 p 轨道全满或半满 |
E 在该周期中未成对电子数最多 |
F 能形成红色(或砖红色)和黑色的两种氧化物 |
请根据以上相关信息,回答问题:
(1)A 的卤化物在工业中有重要作用,A 的四种卤化物的沸点如下表所示:
卤化物 | AF3 | ACl3 | ABr3 | AI3 |
沸点/K | 172 | 285 | 364 | 483 |
①四种卤化物沸点依次升高的原因是_________________。
② ACl3、LiAH4 中A 原子的杂化轨道类型依次为______、_______;与 A3N3H6 互为等电子体的分子的结构简式为___________。
③用AF3分子结构解释反应 AF3(g)+NH4F(s)=NH4AF4(s)能够发生的原因:_________________。
(2)某同学根据上述信息,推断
①B基态原子的核外最子排布为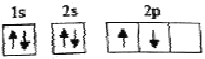 ,该同学所画的电子排布图违背了________。
,该同学所画的电子排布图违背了________。
② 已知元素 B 的一种氢化物是重要的化工原料,常把该氢化物的产量作为衡量石油化工发展水平的标志。有关该氢化物分子的说法正确的是________。
A.分子中含有分子间氢键 B.属于含有极性键的非极性分子
C.只含有4个sp-s的σ键和1个p-p的π键 D.该氢化物分子中 B 原子采用 sp2 杂化
(3)D 基态原子中能量最高的电子,其电子云在空间有______个方向,原子轨道呈______形。
(4)写出 E 原子的电子排布式______________。
(5)请写出 F 元素外围电子排布式_________。向 FSO4溶液中滴加入C元素氢化物的水溶液,先生成蓝色沉淀,后沉淀逐渐溶解,得到深蓝色透明溶液,请写出沉淀溶解的离子方程式__________。