��Ŀ����
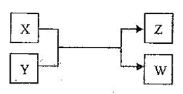
����Ŀ����ͼ�У�A��B��C��D��E�ǵ��ʣ�G��H��I��F��B��C��D��E�ֱ��A�γɵĶ�Ԫ�����

��֪���ٷ�Ӧ![]() �ܷų��������ȣ��÷�Ӧ��Ӧ��������ĺ��ӣ�
�ܷų��������ȣ��÷�Ӧ��Ӧ��������ĺ��ӣ�
��I��һ�ֳ������������壬����![]() ���Է�����Ӧ��2E��I 2F��D��F�е�EԪ�ص���������Ϊ60%.�ش����⣺
���Է�����Ӧ��2E��I 2F��D��F�е�EԪ�ص���������Ϊ60%.�ش����⣺
��1�����з�Ӧ�Ļ�ѧ����ʽΪ_____________________��
��2���������ĵ���ʽΪ________________,���Ŀռ乹����_________��
��3��1.6g G �������ᣬ�õ�����Һ��ͭ����ȫ��Ӧ����������ͭ�۵�����Ϊ g��
��4��C�����NaOH��Һ��Ӧ�����ӷ���ʽΪ_____________����Ӧ����Һ������������Ӧ�����ӷ���ʽ��__________________;
��5��ʵ������һ�����I���ڵ��Լ��ͷ�������___________________��
���𰸡���1��![]()
��2��![]() ֱ������3��0.64g
ֱ������3��0.64g
��4��2Al��2OH����2H2O=2AlO2����3H2�� AlO2����CO2��2H2O=HCO3����Al��OH��3��
��5���Լ�������ʯ��ˮ ��������CO2ͨ�����ʯ��ˮ�У�����Һ���ֻ���˵����CO2���ڡ�
��������
���������![]() �ܷų��������ȣ��÷�Ӧ��Ӧ��������ĺ��ӣ��÷�Ӧ�������ȷ�Ӧ�����������ؽ��������ﷴӦ�û��ؽ�����I��һ�ֳ������������壬��ΪCO2������
�ܷų��������ȣ��÷�Ӧ��Ӧ��������ĺ��ӣ��÷�Ӧ�������ȷ�Ӧ�����������ؽ��������ﷴӦ�û��ؽ�����I��һ�ֳ������������壬��ΪCO2������![]() ���Է�����Ӧ��2E��I =2F��D��E D���ǵ������÷�ӦΪ�û���Ӧ����CO2�����û���Ӧ�ij���Ϊ����þ����MgO��MgԪ�ص���������Ϊ60%����������F�е�EԪ�ص���������Ϊ60%��ͨ��������Ϣ���Եó�AΪO2 ��B �� Fe �� C�� Al��D�� C ��E��Mg��G ��Fe2O3 H��Al2O3 ��I��CO2 F�� MgO��1.6g Fe2O3�� 0.01mol���������ᣬ�õ�����Һ��ͭ����ȫ��Ӧ++Cu=Cu2++2Fe2+ ��2Fe3---Cu�Ĺ�ϵ���ó�����ͭ�۵�����Ϊ0.64g ��
���Է�����Ӧ��2E��I =2F��D��E D���ǵ������÷�ӦΪ�û���Ӧ����CO2�����û���Ӧ�ij���Ϊ����þ����MgO��MgԪ�ص���������Ϊ60%����������F�е�EԪ�ص���������Ϊ60%��ͨ��������Ϣ���Եó�AΪO2 ��B �� Fe �� C�� Al��D�� C ��E��Mg��G ��Fe2O3 H��Al2O3 ��I��CO2 F�� MgO��1.6g Fe2O3�� 0.01mol���������ᣬ�õ�����Һ��ͭ����ȫ��Ӧ++Cu=Cu2++2Fe2+ ��2Fe3---Cu�Ĺ�ϵ���ó�����ͭ�۵�����Ϊ0.64g ��