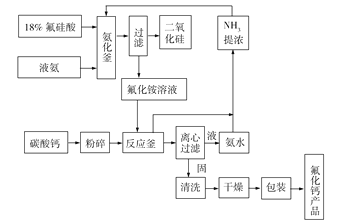
题目内容
【题目】继密胺树脂/石墨烯量子点复合微球新型白光发光材料后,2019年8月13日中国科学院福建物质结构研究所合成了首例缺陷诱导的晶态无机硼酸盐单一组分白光材料Ba2[Sn(OH)6][B(OH)4]2并获得了该化合物的LED器件。
(1)基态O原子能量最高的电子,其电子云在空间有___个延展方向;硼原子的基态电子排布图为____。
(2)NO3-与SO3互为等电子体,构型为___;苯-1,4-二硼酸甲基亚氨基二乙酸酯结构如图所示,硼原子和氮原子的杂化方式分别为___、____。

(3)Fe3+可用SCN-检验,其对应的酸有两种,分别为硫氰酸(H-S-C≡N)和异硫氰酸(H-N=C=S),这两种酸中沸点较高的是___,试分析其原因______。
(4)微量元素硼和镁对植物的叶的生长和人体骨骼的健康有着十分重要的作用,其化合物也应用广泛。①三价B易形成配离子,如[BH4]-等。写出[BH4]-的一种阳离子等电子体___。
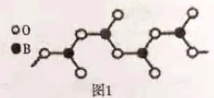
②如图1示多硼酸根的一种无限长的链式结构,其化学式可表示为_____(以n表示硼原子的个数)。
③硼酸晶体是片层结构,如图2表示的是其中一层的结构。每一层内存在的作用力有_____。

【答案】3 ![]() 平面正三角形 sp2 sp3 异硫氰酸(H—N=C=S) 异硫氰酸分子中存在N—H键,硫氰酸分子中存在S—H键,N原子的电负性大于S原子,易形成分子间氢键 NH4+ (BO2)nn- 共价键、氢键
平面正三角形 sp2 sp3 异硫氰酸(H—N=C=S) 异硫氰酸分子中存在N—H键,硫氰酸分子中存在S—H键,N原子的电负性大于S原子,易形成分子间氢键 NH4+ (BO2)nn- 共价键、氢键
【解析】
(1)根据基态O原子核外电子排布,判断能量最高的电子云在空间延展方向。根据构造原理画出硼原子的基态电子排布图;
(2)根据价层电子对互斥理论判断构型和杂化方式;
(3)根据是否存在氢键来判断沸点;
(4)①等电子体是指原子数目相同,价电子总数相同的微粒;
②1个B原子连接3个O原子,其中2个氧原子分别为2个B原子共有,则每个B原子实际结合O原子数目为1+2×12=2,代一个单位负电荷;
③硼酸晶体是片层结构,硼酸分子内存在共价键,分子间存在氢键。
(1)O电子排布式1s2 2s2 2p4可知能量最高的电子在空间有3个延展方向。
硼原子的基态电子排布图为![]()
(2)用VSEPR判定(6-3*0)=3为SP2杂化,平面正三角形,苯-1,4-二硼酸甲基亚氨基二乙酸酯中硼原子和氮原子的杂化方式分别为sp2 sp3
(3)硫氰酸(H-S-C≡N)和异硫氰酸(H-N=C=S)都是分子晶体,从图中可知异硫氰酸(H-N=C=S)分子中存在N—H键,硫氰酸分子中存在S—H键,N原子的电负性大于S原子,易形成分子间氢键,所以异硫氰酸(H-N=C=S)沸点高。
(4)①等电子体是指原子数目相同,价电子总数相同的微粒,则与[BH4]互为等电子体的阳离子有:NH4+等,
②1个B原子连接3个O原子,其中2个氧原子分别为2个B原子共有,则每个B原子实际结合O原子数目为1+2×12=2,代一个单位负电荷,故多硼酸根化学式为:(BO2)nn-
③硼酸晶体是片层结构,硼酸分子内存在共价键,分子间存在氢键。

 阅读快车系列答案
阅读快车系列答案【题目】(1)室温下,在0.5 mol/L的纯碱溶液中加入少量水,由水电离出的c(H+)·c(OH-)_______ (填“变大”、“变小”、“不变”)。
(2)已知Ksp(Ag2CrO4)=1.0×10-12,向0.2 moL的AgNO3溶液中加入等体积的0.08 mol/L K2CrO4溶液,则溶液中的c(CrO42-)=________。
(3)室温下,0.1 mol/L NaHCO3溶液的pH值________0.1 mol/LNa2SO3溶液的pH值(填“>”、“<”、“=”)。
已知:
酸 | 电离平衡常数 | |
H2CO3 | K1=4.3×10-7 | K2=5.6×10-11 |
H2SO3 | K1=1.54×10-2 | K2=1.02×10-7 |
(4)有一种可充电电池Na—Al/FeS,电池工作时Na+的物质的量保持不变,并且是用含![]() 的导电固体作为电解质,已知该电池正极反应式为2Na++FeS+2e-=Na2S+Fe,该电池在充电时,阳极发生反应的物质是________,放电时负极反应式为________。
的导电固体作为电解质,已知该电池正极反应式为2Na++FeS+2e-=Na2S+Fe,该电池在充电时,阳极发生反应的物质是________,放电时负极反应式为________。