题目内容
【题目】常温下,Ksp(CaSO4)=9×10-6,常温下,CaSO4在水中的沉淀溶解平衡曲线如图所示。下列判断错误的是
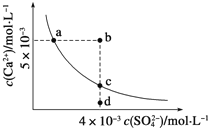
A. a、c两点均可以表示常温下CaSO4溶于水所形成的饱和溶液
B. a点对应的Ksp等于c点对应的Ksp
C. b点将有沉淀生成,平衡后溶液中c(SO42-)一定不等于3×10-3molL-1
D. 向d点溶液中加入适量CaCl2固体可以变到c点
【答案】A
【解析】试题分析:A、其饱和溶液中阴阳离子浓度相等,ac两点阴阳离子浓度不相等,故A错误;B、a、c两点温度相同,Ksp是一常数,温度不变Ksp不变,在曲线上的任意一点Ksp都相等,故B正确;C、根据图示数据,可以看出b点Qc=2×l0-5>Ksp,所以会生成沉淀,后溶液中c(SO42-)一定小于3×10-3molL-1,故C正确;D、d点为不饱和状态,钙离子浓度较小,如加入适量CaCl2固体,钙离子浓度增大,此时硫酸根离子浓度不变,则可以变到c点,故D正确;故选A。

 世纪百通期末金卷系列答案
世纪百通期末金卷系列答案【题目】[化学——选修3:物质结构与性质]
卤族元素的单质和化合物很多,我们可以利用所学物质结构与性质的相关知识去认识和理解它们。
(1)卤族元素位于周期表的_________区;溴的价电子排布式为_________ __________。
(2)在不太稀的溶液中,氢氟酸是以二分子缔合(HF)2形式存在的。使氢氟酸分子缔合的作用力是________________。
(3)请根据下表提供的第一电离能数据判断:最有可能生成较稳定的单核阳离子的卤素原子是_ _
氟 | 氯 | 溴 | 碘 | 铍 | |
第一电离能 (kJ/mol) | 1681 | 1251 | 1140 | 1008 | 900 |
(4)碘在水中的溶解度虽然小,但在碘化钾溶液中溶解度却明显增大这是由于溶液中发生下列反应I-+I2=I3-。I3-离子的中心原子周围σ键电子对对数为___ __,孤电子对对数为__ ____
与KI3类似的,还有CsICl2等。已知CsICl2不稳定,受热易分解,倾向于生成晶格能更大的物质,则它按下列___ __式发生。
A.CsICl2=CsCl+ICl
B.CsICl2=CsI+Cl2
(5)已知ClO2-为V形,中心氯原子周围有四对价层电子。ClO2-中心氯原子的杂化轨道类型为___________,写出一个ClO2-的等电子体__________。
(6)如图为碘晶体晶胞结构。有关说法中正确的是__________。

A.碘分子的排列有2种不同的取向,2种取向不同
的碘分子以配位数4交替配位形成层结构
B.用均摊法可知平均每个晶胞中有4个碘原子
C.碘晶体为无限延伸的空间结构,是原子晶体
D.碘晶体中的碘原子间存在非极性键和范德华力
(7)已知CaF2晶体(见图)的密度为ρg/cm3,NA为阿伏加德罗常数,相邻的两个Ca2+的核间距为a cm,则CaF2的相对分子质量可以表示为__________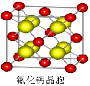 _。
_。
【题目】根据金属活动性顺序表,Cu不能发生反应:Cu+2H2O= Cu(OH)2↓+H2↑。但选择恰当电极材料和电解液进行电解,这个反应就能变为现实。下列四组电极和电解液中,能实现该反应最为恰当的一组是
A | B | C | D | |
阳极 | 石墨棒 | Cu | Cu | Cu |
阴极 | 石墨棒 | Fe | 石墨棒 | Pt |
电解液 | CuSO4溶液 | H2SO4溶液 | Na2SO4溶液 | H2O |
【题目】实验室模拟合成![]() 和CH3CH2CH2Br的方法如下(已知:甲苯和液溴在有少量水存在时也能反应):
和CH3CH2CH2Br的方法如下(已知:甲苯和液溴在有少量水存在时也能反应):
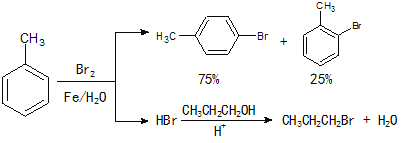
实验室模拟合成对溴甲苯和1-溴丙烷的流程和相关数据如下:
物质 | 甲苯 | 1-丙醇 | 1-溴丙烷 | 对溴甲苯 | 邻溴甲苯 |
沸点(℃) | 110.8 | 97.2 | 71 | 184.3 | 181.7 |

(1)实验室存放液溴的试剂瓶需密闭,同时瓶中要加入 ,以减少溴的挥发。写出甲苯和液溴反应生成对溴甲苯的化学方程式 。
(2)反应装置如图所示:

①图中玻璃仪器a的名称是 , 方块b中为某玻璃仪器,
其名称是 。
②三颈烧瓶中开始加入了甲苯、铁粉和水。加入的适量水的作用是:易于控制温度和 。加热搅拌操作中加入浓硫酸,完成1-丙醇的取代反应,浓硫酸的作用是 。
(3)操作I的名称是 ,操作Ⅲ的名称是 。
(4)操作I分离出的水溶液中含有HBr、H2SO4和Fe3+,某同学为测定溶液的pH,设计方案如下:将所得水溶液稀释至l000mL,取出20.00 mL,用0.1000 mol·L-1 NaOH溶液滴定,以测定溶液pH。该同学认为无需加入指示剂,也能完成滴定。他提出这一观点的理由是 。