题目内容
【题目】氯化铁可用作金属蚀刻、有机合成的催化剂,研究其制备及性质是一个重要的课题。
(1)氯化铁晶体的制备(夹持及加热装置省略):

①实验过程中装置丙中可能发生反应的离子方程式有____________。
②该装置气密性检查方法及操作:_________________________。
(2)氯化铁的性质探究:
为探究氯化铁的性质设计了如下实验。(查阅文献知:①氯化铁的熔点为306℃、沸点为315℃,易升华,气态FeCl3会分解成FeCl2和Cl2 ②FeCl2熔点670℃)
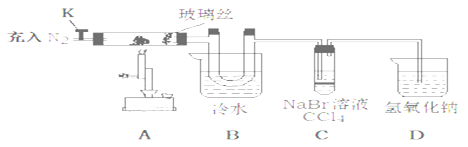
操作步骤 | 实验现象 | 解释原因 |
打开K,充入氮气 | D中有气泡产生 | ①充入N2的原因___________。 |
关闭K,加热至600℃,充分灼烧固体 | B中出现棕黄色固体 | ②产生现象的原因__________________________。 |
实验结束,振荡C静置 | ③_____________ | ④________________________。(用方程式解释) |
【答案】OH-+ H+= H2O、C12+2OH-= ClO-+ Cl-+ H2O关闭两个分液漏斗活塞及弹簧夹2,打开弹簧夹1、3,丙烧杯中盛蒸馏水,将导气管插入烧杯中水中,用酒精灯微热甲装置中的烧瓶,若导管末端产生气泡,停止微热,有水柱形成,说明装置不漏气排出装置内的空气FeCl3易升华溶液分层,上层接近无色,下层为橙红色2FeCl3![]() 2FeCl2+Cl2;2Br-+Cl2=Br2+2Cl-
2FeCl2+Cl2;2Br-+Cl2=Br2+2Cl-
【解析】
(1)①根据装置图,装置甲中二氧化锰与浓盐酸反应生成氯气;装置乙中盐酸与铁反应生成氢气,氢气和氯气反应生成氯化氢和装置甲和乙中挥发出来的氯化氢在丙中与氢氧化钠反应,过量的氯气在丙中与氢氧化钠反应除去;装置丙中可能发生反应的离子方程式有OH-+ H+= H2O、C12+2OH-= ClO-+ Cl-+ H2O,故答案为:OH-+ H+= H2O、C12+2OH-= ClO-+ Cl-+ H2O;
②该装置气密性检查方法及操作为关闭两个分液漏斗活塞及弹簧夹2,打开弹簧夹1、3,丙烧杯中盛蒸馏水,将导气管插入烧杯中水中,用酒精灯微热甲装置中的烧瓶,若导管末端产生气泡,停止微热,有水柱形成,说明装置不漏气,故答案为:关闭两个分液漏斗活塞及弹簧夹2,打开弹簧夹1、3,丙烧杯中盛蒸馏水,将导气管插入烧杯中水中,用酒精灯微热甲装置中的烧瓶,若导管末端产生气泡,停止微热,有水柱形成,说明装置不漏气;
(2)①为防止空气对实验的干扰,打开K,充入氮气,故答案为:排出装置内的空气;
②FeC13易升华,B中出现棕黄色固体,故答案为:FeC13易升华;
③充入氮气,关闭K,加热至600℃,充分灼烧固体,2FeC13![]() 2FeCl2+Cl2,
2FeCl2+Cl2,
生成的氯气通入C装置,2Br-+Cl2=Br2+2Cl-,四氯化碳密度比水重,萃取溴单质,使C中溶液分层,上层接近无色,下层橙红色,故答案为:溶液分层,上层接近无色,下层橙红色;
④灼烧固体,2FeC13![]() 2FeCl2+Cl2,生成的氯气在C装置中与溴化钠发生置换,2Br-+Cl2=Br2+2Cl-;故答案为:2FeC13
2FeCl2+Cl2,生成的氯气在C装置中与溴化钠发生置换,2Br-+Cl2=Br2+2Cl-;故答案为:2FeC13![]() 2FeCl2+Cl2,2Br-+Cl2=Br2+2Cl-。
2FeCl2+Cl2,2Br-+Cl2=Br2+2Cl-。


