题目内容
【题目】如图是模拟石油深加工来合成丙烯酸乙酯等物质的过程,请回答下列问题:
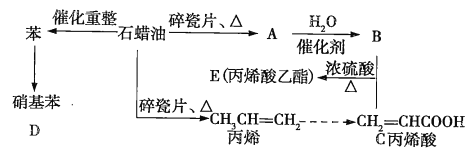
(1)A的结构简式为__________________。
(2)写出B+C→E的化学方程式:____________________________________,反应类型为__________________。
(3)在催化剂条件下,由丙烯酸还可生成聚丙烯酸塑料,写出该反应的化学方程式:______________________________,反应类型为______________________________。
(4)写出由苯生成硝基苯的化学方程式:______________________________,反应类型为_______________。
【答案】CH2=CH2 CH2=CH-COOH+C2H5OH![]() CH2=CH-COOC2H5+H2O 酯化反应 nCH2=CH-COOH
CH2=CH-COOC2H5+H2O 酯化反应 nCH2=CH-COOH![]()
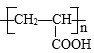 加聚反应
加聚反应 ![]() +HNO3
+HNO3![]()
![]() +H2O 取代反应
+H2O 取代反应
【解析】
B与丙烯酸反应生成丙烯酸乙酯,为酯化反应,可知B为乙醇,A与水发生加成反应生成乙醇,则A为乙烯,丙烯含有碳碳双键,可发生加聚反应生成聚丙烯,据此解答。
(1)B与丙烯酸反应生成丙烯酸乙酯,则B为乙醇,A与水在催化剂条件下反应生成乙醇,则A为乙烯,结构简式为CH2=CH2;
(2)B是乙醇,结构简式是C2H5OH,分子中含有官能团-OH,C为丙烯酸,结构简式是CH2=CH-COOH,分子中含有官能团-COOH,二者在浓硫酸存在条件下加热发生酯化反应生成丙烯酸乙酯和水,由于该反应是可逆反应,故反应的化学方程式为CH2=CH-COOH+C2H5OH![]() CH2=CH-COOC2H5+H2O;
CH2=CH-COOC2H5+H2O;
(3)丙烯酸分子中含有不饱和的碳碳双键,在一定条件下可发生加聚反应生成聚丙烯酸,反应的化学方程式为nCH2=CH-COOH![]()
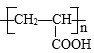 ;
;
(4)苯与浓硝酸在浓硫酸、加热条件下发生取代反应生成硝基苯,化学方程式为![]() +HNO3
+HNO3![]()
![]() +H2O。
+H2O。

【题目】甲烷催化裂解是工业上制备乙炔的方法之一。回答下列问题:
(1)已知:CH4(g)+2O2(g)=CO2(g)+2H2O(l) ΔH1=-890 kJ·mol-1
C2H2(g)+![]() O2(g)=2CO2(g)+H2O(l) ΔH2=-1 300 kJ·mol-1
O2(g)=2CO2(g)+H2O(l) ΔH2=-1 300 kJ·mol-1
2H2(g)+O2(g)=2H2O(l) ΔH3=-572 kJ·mol-1
则2CH4(g)![]() C2H2(g)+3H2(g) ΔH=________kJ·mol-1。
C2H2(g)+3H2(g) ΔH=________kJ·mol-1。
(2)某科研小组尝试利用固体表面催化工艺进行CH4的裂解。
①若用![]() 和
和![]() 分别表示CH4、C2H2、H2和固体催化剂,在固体催化剂表面CH4的裂解过程如图所示。从吸附到解吸的过程中,能量状态最低的是________(填字母)。
分别表示CH4、C2H2、H2和固体催化剂,在固体催化剂表面CH4的裂解过程如图所示。从吸附到解吸的过程中,能量状态最低的是________(填字母)。
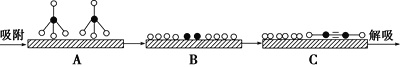
②在恒容密闭容器中充入a mol甲烷,测得单位时间内在固体催化剂表面CH4的转化率[α(CH4)]与温度(t)的关系如图所示,t0 ℃后CH4的转化率突减的原因可能是_______。

(3)甲烷分解体系中几种气体的平衡分压(p,单位为Pa)与温度(t,单位为℃)的关系如图所示:
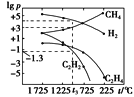
①t1 ℃时,向V L恒容密闭容器中充入0.12 mol CH4,只发生反应2CH4(g)![]() C2H4(g)+2H2(g),达到平衡时,测得p(C2H4)=p(CH4),CH4的平衡转化率为________。(保留3位有效数字)若改变温度至t2 ℃,CH4以0.01mol/(L· s)的平均速率增多,则t1________t2(填“>”“=”或“<”)。
C2H4(g)+2H2(g),达到平衡时,测得p(C2H4)=p(CH4),CH4的平衡转化率为________。(保留3位有效数字)若改变温度至t2 ℃,CH4以0.01mol/(L· s)的平均速率增多,则t1________t2(填“>”“=”或“<”)。
②在图中,t3 ℃时,化学反应2CH4(g)![]() C2H2(g)+3H2(g)的压强平衡常数Kp=____。
C2H2(g)+3H2(g)的压强平衡常数Kp=____。
(4)工业上,以石墨为电极,电解亚铁氰化钾K4[Fe(CN)6]溶液可以制备铁氰化钾{K3[Fe(CN)6],可用于检验Fe2+},阳极的电极反应式为____________。
(5)设计如图实验探究牺牲阳极的阴极保护法原理:
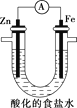
操作 | 现象 |
(i)取铁极附近的溶液于试管中,滴加铁氰化钾溶液 | 无明显现象 |
(ii)在U形管铁极附近滴加铁氰化钾溶液 | 产生蓝色沉淀 |
得出结论:①锌______保护铁;(填“能”或“不能”)
②产生蓝色沉淀可以得出铁被铁氰化钾氧化生成______。