题目内容
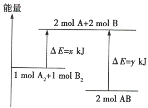
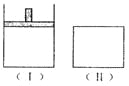
【题目】如右图,在一定温度下,Ⅰ为恒压密闭容器,Ⅱ为恒容密闭容器。在Ⅰ、Ⅱ中分别加入2 mol A和2 mol B,起始时容器体积均为V L,发生如下反应并达到化学平衡状态: 2A十B![]() xC(g),平衡时两容器中A、B、C的物质的量之比均为1:3:6。下列说法一定正确的是
xC(g),平衡时两容器中A、B、C的物质的量之比均为1:3:6。下列说法一定正确的是
A.x的值为3B.B物质可为固体或液体
C.Ⅰ、Ⅱ容器中从起始到平衡所需时间相同D.平衡时,Ⅰ容器的体积小于V L
【答案】C
【解析】
在一定温度下,Ⅰ为恒压密闭容器,Ⅱ为恒容密闭容器,平衡时两容器中A、B、C的物质的量之比均为1:3:6,说明A、B转化率相同,则A、B的平衡状态相同,说明反应2A+BxC(g)中,反应前后气体的化学计量数之和相等,以此解答该题。
在一定温度下,Ⅰ为恒压密闭容器,Ⅱ为恒容密闭容器,平衡时两容器中A、B、C的物质的量之比均为1:3:6,说明A、B转化率相同,则A、B的平衡状态相同,说明反应2A+BxC(g)中,反应前后气体的化学计量数之和相等,则
A.如A为固体或液体,B为气体,x=1,选项A错误;
B.如x=1,则B为气体,A为固体或液体,如A为气体,B为固体或液体,则x=2,选项B错误;
C.反应2A+BxC(g)中,反应前后气体的化学计量数之和相等,气体的压强不变,体积不变,达到平衡用的时间相同,选项C正确;
D.平衡时,Ⅰ容器的体积等于VL,选项D错误;
答案选C。

【题目】通常人们把拆开1mol某化学键所吸收的能量或形成1mol某化学键所释放的能量看作该化学键的键能,键能的大小可用于估算化学反应的反应热(△H),已知:
化学键 | H-H | Cl-Cl | H-Cl |
键能 | 436kJ/mol | 243kJ/mol | 431kJ/mol |
则下列热化学方程式不正确的是___(把正确的一个选项填在横线上)
a.![]() H2(g)+
H2(g)+![]() Cl2(g)═HCl(g) △H=﹣91.5kJmol﹣1
Cl2(g)═HCl(g) △H=﹣91.5kJmol﹣1
b.H2(g)+Cl2(g)═2HCl(g) △H=﹣183kJmol﹣1
c.2HCl(g)═H2(g)+Cl2(g) △H=+183kJmol﹣1
d.![]() H2(g)+
H2(g)+![]() Cl2(g)═HCl(g) △H=+91.5kJmol﹣1
Cl2(g)═HCl(g) △H=+91.5kJmol﹣1