题目内容
实验室可用环己醇(沸点:160.84℃,微溶于水)制备环己酮(沸点:155.6℃,微溶于水),使用的氧化剂可以是次氯酸钠、重铬酸钾等。
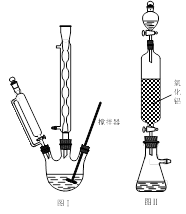
下列装置分别是产品的合成装置和精制装置示意图: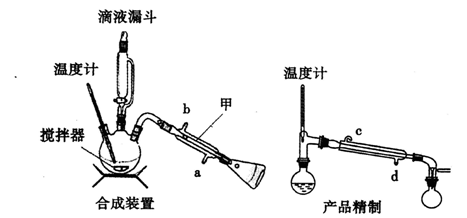
合成实验过程如下:
向装有搅拌器、滴液漏斗和温度计的三颈烧瓶中依次加入5.2 mL环己醇和25 mL冰醋酸。开动搅拌器,将40 mL次氯酸钠溶液逐渐加入到反应瓶中,并使瓶内温度维持在30~35℃,用磁性搅拌器搅拌5 min。然后,在室温下继续搅拌30 min后,在合成装置中再加入30 mL水、3g氯化铝和几粒沸石,加热蒸馏至馏出液无油珠滴出为止。
回答下列问题:
(1)在合成装置中,甲装置的名称是 。
(2)三颈烧瓶的容量为 (填“50 mL"、“100 mL”或“250 mL")。
(3)滴液漏斗具有特殊的结构,主要目的是____ 。
(4)蒸馏完成后,向馏出液中分批加入无水碳酸钠至反应液呈中性为止,其目的是 。然后加入精制食盐使之变成饱和溶液,将混合液倒人____ 中,分离得到有机层。
(5)用如上右图对粗产品进行精制,蒸馏收集____ ℃的馏分。
(6)检验坏己酮是否纯净,可使用的试剂为____ 。
A.重铬酸钾溶液 B.金属钠 C.新制的氢氧化铜悬浊液
⑴冷凝管(1分)⑵250mL(1分)⑶使所加液体能顺利滴入三颈瓶中(1分)⑷除去产品中混有的醋酸杂质(2分)分液漏斗(1分)⑸155.6(1分)⑹AB(2分)
解析

 一线名师提优试卷系列答案
一线名师提优试卷系列答案 阳光试卷单元测试卷系列答案
阳光试卷单元测试卷系列答案(12分)苯甲酸甲酯是一种重要的工业原料,某化学小组采用如下图装置,以苯甲酸、甲醇为原料制取苯甲酸甲酯。有关物质的物理性质见下表所示: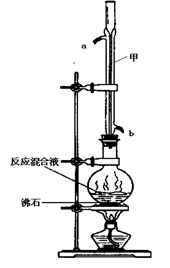
| | 苯甲酸 | 甲醇 | 苯甲酸甲酯 |
| 熔点/℃ | 122.4 | -97 | -12.3 |
| 沸点/℃ | 249 | 64.3 | 199.6 |
| 密度/g.cm-3 | 1.2659 | 0.792 | 1.0888 |
| 水溶性 | 微溶 | 互溶 | 不溶 |
(1)甲装置的作用是: ;冷却水从 (填“a”或“b”)口进入。
(2)化学小组在实验中用过量的反应物甲醇,其理由是 。
Ⅱ.粗产品的精制
苯甲酸甲酯粗产品中往往含有少量甲醇、硫酸、苯甲酸和水等,现拟用下列流程进行精制

(1)试剂1可以是 (填编号),作用是 。
A.稀硫酸 B.碳酸钠溶液 C. 乙醇
(2)操作2中,收集产品时,控制的温度应在 ℃左右。
(3)实验制得的苯甲酸甲酯精品质量为10g,则苯甲酸的转化率为 (结果保留三位有效数字)。
(4)本实验制得的苯甲酸甲酯的产量低于理论产量,可能的原因是 (填编号)。
A.蒸馏时从100℃开始收集产品 B.甲醇用量多了 C.制备粗品时苯甲酸被蒸出
某课外小组设计的实验室制取乙酸乙酯的装置如图所示,A中放有浓硫酸,B中放有乙醇、无水醋酸钠,D中放有饱和碳酸钠溶液。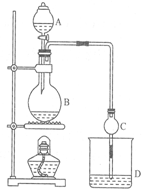
已知:①无水氯化钙可与乙醇形成难溶于水的CaCl2·6C2H5OH
②有关有机物的沸点:
| 试剂 | 乙醚 | 乙醇 | 乙酸 | 乙酸乙酯 |
| 沸点/℃ | 34.7 | 78.5 | 118 | 77.1 |
(1)浓硫酸的作用:________________;若用同位素18O示踪法确定反应产物水分子中氧原子的提供者,写出能表示18O位置的化学方程式:
(2)球形干燥管C的作用是 反应前向D中加入几滴酚酞,反应结束后D中的现象是 。
(3)从D中分离出的乙酸乙酯中常含有一定量的乙醇、乙醚和水,应先加入无水氯化钙,分离出____________;再加入(此空从下列选项中选择)_________;然后进行蒸馏,收集77℃左右的馏分,以得到较纯净的乙酸乙酯:
A.五氧化二磷 B.碱石灰 C.无水硫酸钠 D.生石灰
下列关于煤的叙述中不正确的是
| A.煤是工业上获得苯及同系物的一种重要来源 |
| B.煤的干馏过程只有化学变化 |
| C.煤是由多种有机物和少量无机物组成的混合物 |
| D.煤除了主要含有碳元素外,还含有少量的氢、氮、硫、氧等元素 |
石油和煤都是重要的化石能源,下列有关石油和煤的叙述正确的是
| A.都是纯净物 | B.都含有碳元素 | C.都是可再生能源 | D.都有固定的沸点 |
下列关于有机化合物的说法正确的是( )
| A.乙酸和乙酸乙酯可用Na2CO3溶液加以区别 | B.汽油、乙烯均为石油分馏产品 |
| C.可以用分液的方法分离硝基苯和苯 | D.有机化合物都能燃烧 |
 ),可以使用的仪器分析方法是 。
),可以使用的仪器分析方法是 。