题目内容
(5分)向盛有1 mL 0.1 mol/L MgCl2溶液的试管中滴加2滴(1滴约0.05mL)2mol/L NaOH溶液,有白色沉淀生成,再滴加2滴0.1mol/LFeCl3溶液,静置。可以观察到的现象是 ,产生该现象的原因是 。
白色沉淀转变为红褐色沉淀 因为开始生成的白色沉淀Mg(OH)2 存在溶解平衡Mg(OH)2(s) Mg2+(aq)+2OH—(aq),滴入的FeCl3溶液电离的Fe3+与溶解平衡产生的OH—反应生成溶度积更小(或更难溶)的Fe(OH)3,使Mg(OH)2的溶解平衡继续向右移动,直至Mg(OH)2全部转化为Fe(OH)3沉淀。
Mg2+(aq)+2OH—(aq),滴入的FeCl3溶液电离的Fe3+与溶解平衡产生的OH—反应生成溶度积更小(或更难溶)的Fe(OH)3,使Mg(OH)2的溶解平衡继续向右移动,直至Mg(OH)2全部转化为Fe(OH)3沉淀。
解析试题分析:向盛有1 mL 0.1 mol/L MgCl2溶液的试管中滴加2滴(1滴约0.05mL)2mol/L NaOH溶液,由于Mg2+的浓度、OH-浓度平方的乘积大于Ksp(Mg(OH)2),所以会产生Mg(OH)2白色沉淀生成,Mg(OH)2在溶液中存在沉淀溶解平衡,当再滴加2滴0.1mol/LFeCl3溶液时,由于c(Fe3+)·c(OH-)3> Ksp(Fe(OH)3),因此会发生沉淀转化,产生更难溶解的Fe(OH)3,Mg(OH)2的溶解平衡继续向右移动,直至Mg(OH)2全部转化为Fe(OH)3沉淀。静置后又可以观察到的现象是白色沉淀转变为红褐色沉淀。
考点:考查沉淀溶解平衡及沉淀的转化的知识。

 名师伴你成长课时同步学练测系列答案
名师伴你成长课时同步学练测系列答案常温下,pH=8~9的Na2SO3溶液中存在:SO32ˉ+H2O HSO3ˉ+OHˉ,下列说法正确的是
HSO3ˉ+OHˉ,下列说法正确的是
| A.加入少量NaOH固体,Kw增大 |
| B.c(OHˉ)= c(HSO3ˉ)+2 c(H2SO3)+ c(H+) |
| C.c(SO32ˉ)> c(OHˉ) > c(HSO3ˉ) |
| D.加入稀盐酸,c(HSO3ˉ)减小 |
某温度下, pH值相同的盐酸和氯化铵溶液分别稀释,平衡pH值随溶液体积变化的曲线如下图所示。据图判断下列叙述中,正确的是( )
| A.Ⅱ为氯化铵稀释时pH值变化曲线,a点水的电离程度大于c点水的电离程度 |
| B.b点溶液中水的电离程度比c点溶液中水的电离程度大,且两点的KW相同 |
| C.a点时,等体积的两溶液与NaOH反应消耗的NaOH量相同 |
| D.加入足量NaOH,b点溶液消耗的NaOH比d点溶液消耗的多 |
能说明醋酸是弱电解质的事实是:
①用浓硫酸和醋酸钠固体共热可以制得醋酸,②醋酸钠水溶液呈碱性,
③可以用食醋清除水壶中的水垢,④pH=2的醋酸溶液稀释1000倍后的pH<5
| A.①③④ | B.①② | C.②④ | D.② |
已知25℃时,AgCl的溶度积 ,则下列说法正确的是:
,则下列说法正确的是:
| A.向饱和AgCl水溶液中加入盐酸,Ksp值变大 |
B.AgNO3溶液与NaCl溶液混合后的溶液中,一定有 |
C.温度一定时,当溶液中 时,此溶液中必有AgCl的沉淀析出 时,此溶液中必有AgCl的沉淀析出 |
| D.将AgCl加入到较浓的KI溶液中,部分AgCl转化为AgI,因为AgCl溶解度大于AgI |
(6分)水溶液中存在水的电离平衡。
(1)常温时,在稀溶液中c(H+)和c(OH-)的乘积总是等于 。
(2)用“>”、“<”或“=”填空: 碱性溶液中,c(H+) c(OH-),在常温时pH 7。
(3)有下列几种溶液:
| A.NH3·H2O | B.CH3COONa | C.NH4Cl | D.NaHSO4 |
用离子方程式或电离方程式表示这些溶液呈酸性的原因:___________________________________。
锅炉水垢既会降低燃料的利用率、影响锅炉的使用寿命,还可能造成安全隐患。
某锅炉水垢的主要成分有CaCO3、CaSO4、Mg(OH)2、Fe2O3,用酸洗法可除去该水垢,其基本原理如下图所示。
(1)酸洗时,为使水垢尽可能溶解,不宜选用的是 (填标号)。
| A.醋酸 | B.盐酸 | C.硝酸 | D.稀硫酸 |
(3)洗出液中的Fe3+会腐蚀铁质管道,反应的离子方程式是 ,因此,常在洗出液中加入具有强还原性的SnCl2溶液,反应中的Sn2+与Fe3+的物质的量之比为1∶2,Sn2+转化为 (填离子符号)。
(4)柠檬酸(用H3R表示)可用作酸洗剂,溶液中H3R、H2R-、HR2-、R3-的含量与pH的关系如图
所示。图中a曲线所代表的微粒的百分含量随溶液pH的改变而变化的原因是 。
调节柠檬酸溶液的pH=4,有利于除去水垢中的氧化铁。pH=4时,溶液中上述4种微粒含量最多的是 。

【化学与技术】
电镀厂镀铜废水中含有CN-和Cr2O72-离子,需要处理达标后才能排放。该厂拟定下列流程进行废水处理,回答下列问题: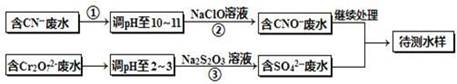
(1)上述处理废水流程中主要使用的方法是______。
(2)②中反应后无气体放出,该反应的离子方程式为 。
(3)步骤③中,每处理0.4mol Cr2O72-时转移电子2.4mol,该反应离子方程式为 。
(4)取少量待测水样于试管中,加入NaOH溶液,观察到有蓝色沉淀生成,再加Na2S溶液,蓝色沉淀转化成黑色沉淀,请使用化学用语和文字解释产生该现象的原因 。
(5)目前处理酸性Cr2O72-废水多采用铁氧磁体法。该法是向废水中加入FeSO4·7H2O将Cr2O72-还原成Cr3+,调节pH,Fe、Cr转化成相当于FeII[FeCr]O4(铁氧磁体,罗马数字表示元素价态)的沉淀。处理1mol Cr2O72-,需加入a mol FeSO4?7H2O,下列结论正确的是_______。
| A.x ="0.5" ,a =8 | B.x =0.5,a = 10 |
| C.x =" 1.5" ,a =8 | D.x =" 1.5" ,a = 10 |
(1)25 ℃时,0.1 mol·L-1 NaOH溶液的pH为 ;
(2)25 ℃时,0.1 mol·L-1 NH4Cl溶液的pH 7(填“<”“=”或“>”),其原因是 (用离子方程式表示);
(3)将上述两种溶液等体积混合后,离子浓度大小次序正确的是 (填序号)。
| A.c(Na+)>c(Cl-)>c(OH-)>c(H+) |
| B.c(Na+)=c(Cl-)>c(H+)>c(OH-) |
| C.c(Na+)=c(Cl-)>c(OH-)>c(H+) |
| D.c(Cl-)>c(Na+)>c(OH-)>c(H+) |